
填空:
(1)用电子式表示H2O和MgBr2的形成过程H2O
MgBr2
(2)写出CO2、Na2O2、H2O2的电子式:CO2 Na2O2 HClO
(3)依据事实,写出下列反应的热化学方程式.
①若适量的N2和O2完全反应,如果生成23g NO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为
②已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣25kJ/mol①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣47kJ/mol②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ/mol③
请写出CO还原FeO的热化学方程式: .
考点:
用盖斯定律进行有关反应热的计算;电子式;用电子式表示简单的离子化合物和共价化合物的形成.
分析:
(1)水是共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示其形成过程时,左边是原子的电子式,右边为水分子的电子式,中间用箭头连接;溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示其形成过程时,左边是原子的电子式,右边为溴化镁的电子式,中间用箭头连接;
(2)二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;过氧化钠为离子化合物,钠离子用离子符号表示,阴离子需要标出所带电荷及最外层电子;HClO为共价化合物,分子中存在1个氧氢键和1个Cl﹣O键;
(3)①根据每生成23克NO2需要吸收16.95kJ热量,计算2molNO2燃烧放出的热量,结合化学方程式书写热化学方程式;
②已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=﹣25KJ/mol…①,
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=﹣47KJ/mol…②,
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,
根据盖斯定律将方程式变形(3×①﹣②﹣2×③)÷6得:
Fe(s)+CO(g)═Fe(s)+CO2(g),△H.
解答:
解:(1)H2O为共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示形成过程为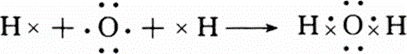 ,
,
溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为 ,
,
故答案为: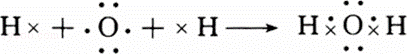 ;
;
 ;
;
(2)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: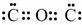 ;
;
Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为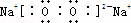 ;
;
HClO为共价化合物,分子中存在1个氧氢键和1个Cl﹣O键,次氯酸的电子式为: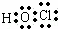 ;
;
故答案为: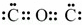 ;
;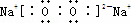 ;
;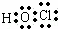 ;
;
(3)①适量的N2和O2完全反应,每生成23克NO2需要吸收16.95 kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ/mol,
故答案为:N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol;
②Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=﹣25KJ/mol…①,
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=﹣47KJ/mol…②,
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,
根据盖斯定律将方程式变形(3×①﹣②﹣2×③)÷6得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1﹣△H2﹣2×△H3)÷6=﹣11KJ/mol.
故答案为:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=﹣11KJ/mol.
点评:
本题考查了电子式的表示方法及其综合应用、热化学方程式的书写,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,注意掌握离子化合物与共价化合物的电子式的表示方法.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
人们每天都要摄入大量的淀粉类物质,以维持机体的营养均衡。这是因为淀粉在淀粉酶作用下或在酸性环境下可以水解成葡萄糖:
(C6H10O5)n+nH2O nC6H12O6
nC6H12O6
(1)已知葡萄糖化学式是C6H12O6,试推导葡萄糖分子的结构简式,已知多元醇与新制Cu(OH)2悬浊液混合可形成绛蓝色溶液。
(2)实验证明,人在长期饥饿或肝功能减退的情况下,会出现头晕、心慌、出冷汗等症状。而当一个人多食少动使得摄入的糖类过多时,又会导致肥胖。试由此推导葡萄糖在人体内的变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O俗称“笑气”,曾用作可吸入性 麻醉剂,产生N2O反应:3CO+2NO2═3CO2+N2O.
麻醉剂,产生N2O反应:3CO+2NO2═3CO2+N2O.
下列说法正确的是( )
A.反应中每生成l mol N2O,转移4mol电子 B.N2O只有氧化性,无还原性
C.N2O 和CO2互为等电子体 D.NO2属于酸性氧化物
和CO2互为等电子体 D.NO2属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
关于硝酸的说法正确的是( )
|
| A. | 硝酸与金属反应时,主要是+5价的氮得电子 |
|
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 |
|
| C. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
|
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
①H2(g)+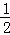 O2(g)═H2O(g)△H1=a kJ•mol﹣1②2H2(g)+O2(g)═2H2O(g)△H2=b kJ•mol﹣1
O2(g)═H2O(g)△H1=a kJ•mol﹣1②2H2(g)+O2(g)═2H2O(g)△H2=b kJ•mol﹣1
③H2(g)+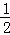 O2(g)═H2O(l)△H3=c kJ•mol﹣1④2H2(g)+O2(g)═2H2O(l)△H4=d kJ•mol﹣1
O2(g)═H2O(l)△H3=c kJ•mol﹣1④2H2(g)+O2(g)═2H2O(l)△H4=d kJ•mol﹣1
下列关系式中正确的是( )
|
| A. | a<c<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .请指出装置中的另外错误是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热 (填“偏大”“偏小”“无影响”).
(4)实验中改用60mL 0.50 mol•L﹣1的盐酸跟60mL 0.55 mol•L﹣1NaOH溶液进行上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”).
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
| a极板 | b极板 | X电极 | 电解质溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
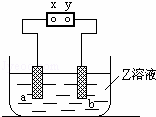
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)若同温同压下测得反应前后混合气体的密度比为0.9:1,则反应掉的SO2是原有SO2的百分之几?
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C8H10的有机物A与氯气反应生成产物有多种,产物之一B可发生,下列转化合成聚酯类高分子材料,
其合成路线如下:
已知:①同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
②物质C可发生银镜反应.
请根据以上信息回答下列问题:
(1)B的结构简式为 ,其中的官能团名称为 .
(2)写出下列反应的化学方程式:C与银氨溶液的反应 ,由D生成高分子化合物的反应
(3)C的同分异构体中属于芳香族化合物且能发生水解反应的有6种,其中既能发生水解反应,又能发生银镜反应的有 种.
(4)格氏试剂在有机合成方面用途广泛,可用卤代烃和镁在醚类溶剂中反应制得.设R为烃基,已知:
R﹣X+Mg  R﹣Mg X(格氏试剂);
R﹣Mg X(格氏试剂);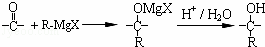
根据以上信息,用C物质和格氏试剂合成另一种高分子化合物 在合成过程中所用的格氏试剂的化学式为 (用X表示卤原子),合成过程中涉及到的有机化学反应类型有 (填编号)
在合成过程中所用的格氏试剂的化学式为 (用X表示卤原子),合成过程中涉及到的有机化学反应类型有 (填编号)
A.加成反应 B.加聚反应 C.氧化反应 D.缩聚反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com