
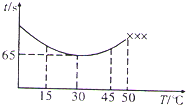
 NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.
NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 30 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| △c |
| △t |
| △c |
| △t |
| ||
| 65s |
| 2n |
| 40×10-3×65 |
| 2n |
| 40×10-3×65 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将NaHSO3溶液与过量KIO3溶液混合,用测速仪测定其起始时的反应速率v(甲);在烧杯乙中进行同一反应(不同的是乙烧杯中预先加入少量Na2SO4或K2SO4粉末,其他反应条件均完全相同),测定其起始阶段的相同时间内的反应速率v(乙) | 若v(甲)=v(乙),则假设一不成立;若v(甲)<v(乙),则假设一成立 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
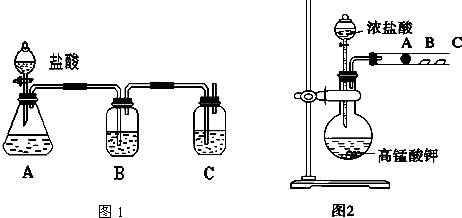
 某兴趣小组设计如图实验装置进行实验.
某兴趣小组设计如图实验装置进行实验.
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊, 则“吸收液”中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 | 则“吸收液”中存在 SO32-. |
| 步骤3: | 则“吸收液”中存在 HSO3-. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
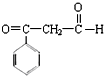 是一种重要的化工原料.A、B、C、D、E之间的转化关系如图:
是一种重要的化工原料.A、B、C、D、E之间的转化关系如图: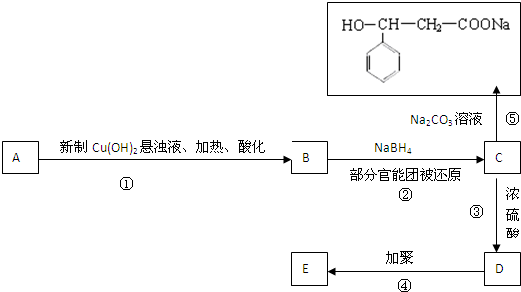
查看答案和解析>>
科目:高中化学 来源: 题型:
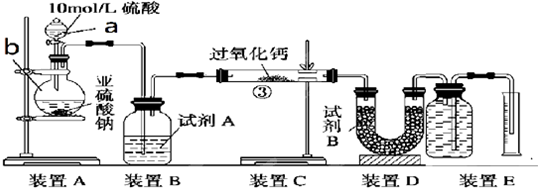
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com