
在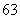 Li、
Li、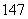 N、
N、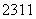 Na、
Na、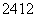 Mg、
Mg、 L
L i、
i、 C中:
C中:
(1)________和________互为同位素。
(2)________和________质量数相等,但不能互称同位素。
(3)________和________的中子数相等,但质子数不相等,所以不是同一种元素
科目:高中化学 来源: 题型:
下列关于工业生产的说法正确的是
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽一般用铁网作电极
D.合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
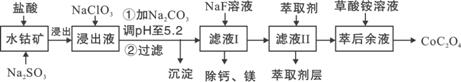 |
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
 (3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:____________________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:____________________。
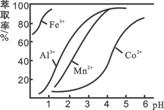
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取
剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.酸性:HClO4>H2SO4>H3PO4 B.原子半径:Cl>S>O
C.稳定性:HBr>HCl>HF D.金属性:Al>Mg>Na
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数为11~17号的元素,随核电荷数的递增,以下各项内容的变化是
(1)各元素的原子半径依次________。
(2)各元素原子的电子层数______ __,最外层电子数依次________。
__,最外层电子数依次________。
(3)元素的金属性逐渐________,而非金属性逐渐________,元素失电子能力逐渐________
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)(9分)写出下列反应的化学方程式:
①实验室制取氨气 ___________________________________________
②浓硝酸的见光分解_______________________________________
③二氧化氮和水反应_______________________
(2)(10分)A、B、C、D为中学常见物质且均含有同一种元素,相互转化关系如图(反应条件及其他物质已经略去):
A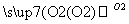 B
B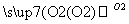 C
C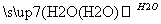 D
D
①若A、B、C、D均为含硫化合物,其中的B具有漂白性,而且它们的水溶液均能使湿润的蓝色石蕊试纸变红,则D为(填写化学式):______。写出B→C的化学方程式:_____________。
②若A是氢化物,其水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则D的化学式为______。写出A→B的化学方程式: ________________。
③若A为金属单质,组成元素的原子所含质子的数目小于18,D为强碱,写出C→D的化学方程式:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A | B | C | D | |
| 实验 | 用CCl4 提取溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
| 装置或仪器 |
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com