
Diels-Alder反应为共轭双烯与含烯键或炔键的化合物相互作用生成六元环状化合物的
反应,最简单的Diels-Alder反应是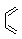 +
+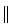

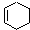 。
。
氯丁橡胶是理想的电线电缆材料,其单体2-氯-1,3-丁二烯也是一种重要的有机合成中间体,该单体的一种合成路线及有关转化关系图如下。
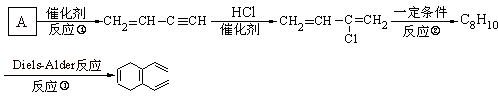
已知:CH2=CH-C≡CH由A二聚得到。
回答下列问题:
45.A的结构式为_____________________,反应①的反应类型是________________。
46.A在一定条件下可以四聚成环状化合物C8H8,其结构简式为_________________。
47.C8H8的一种同分异构体属于芳香烃,该芳香烃与1,3-丁二烯可以合成丁苯橡胶,写出此合成反应的化学方程式_________________________________________________。
48.写出反应③的化学方程式_________________________________________________。
49.2-氯-1,3-丁二烯的另一种制法是由1,3-丁二烯通过两步反应制得,写出有关的化学方程式。
科目:高中化学 来源: 题型:
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2
和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、
。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室常用铜与浓硝酸反应来制取NO2气体,该反应的离子方程式是______
__________________________________。
(2)若将25.6g铜跟一定量的浓硝酸反应,铜耗完时,共产生11.2L气体(标准状况下),在该反应中,转移电子的数目是__________,则被还原的硝酸为________mol,生成NO2的体积为____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是
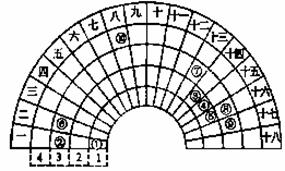
A.②、⑧、⑨对应简单离子半径依次减小
B.⑥的氯化物的熔点比⑦的氯化物熔点低
C.元素⑩处于常见周期表第四周期第VIIIB族
D.①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系正确的是
A.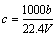 B.
B.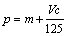 C.n=m+17Vc D.
C.n=m+17Vc D.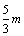 <p<
<p<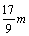
查看答案和解析>>
科目:高中化学 来源: 题型:
课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、
橙汁、烧杯等用品探究原电池的组成。下列结论错误的是
A.原电池是将化学能转化成电能的装置
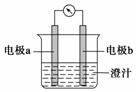 B.原电池由电极、电解质溶液和导线等组成
B.原电池由电极、电解质溶液和导线等组成
C.图中a极为铝条、b极为锌片时,导线中会产生电流
D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 。
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液
⑤加过量的BaCl2溶液
a.②⑤④①③ b.①④②⑤③ c.④②⑤③① d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 。
(4)步骤II反应的离子方程式__________________________________________。
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产 ,请解释原因 。
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你_______(选填“同意”,“不同意”)该说法,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气分子的空间构型为三角锥形,而甲烷则是正四面体形,这是因为( )
A.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
D.氨气分子是极性分子而甲烷是非极性分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com