
| 消耗量 |
| 起始量 |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| 1.2×1.2 |
| 0.8×1.8 |
| 1.2mol |
| 3mol/L |
| x2 |
| (2-x)(6-x) |
| 1.5mol |
| 6mol/L |
| c2 |
| (a-c)(b-c) |


科目:高中化学 来源: 题型:
A、vA=
| ||
B、vB=
| ||
| C、vC=4vB | ||
D、vD=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠与硝酸;氢氧化钾与盐酸 |
| B、碳酸钠与硝酸;碳酸氢钠与盐酸 |
| C、硫酸与氢氧化钡;硫酸雨氯化钡 |
| D、硫酸铜与氢氧化钡;氯化铜与氢氧化钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
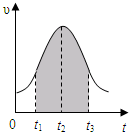 实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:
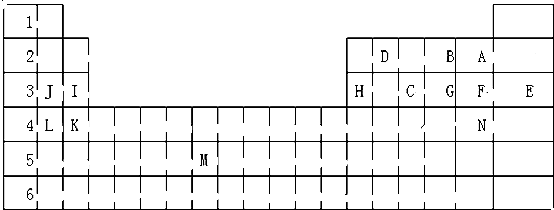
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

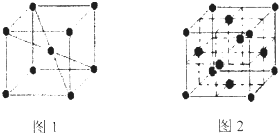
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com