
| A、Ca(OH)2+CO2═CaCO3↓+H2O |
| B、CO2+C═2CO |
| C、Fe2O3+3C═4 Fe+3 CO2 |
| D、C+2H2O═2H2+CO2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| 平衡常数K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
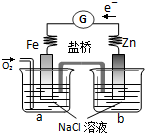
| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH升高 |
| C、烧杯b中发生的电极反应为Zn-2e-=Zn2+ |
| D、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳的燃烧热大于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的俗名:Na2CO3-小苏打 NaOH-苛性钠 |
| B、物质的分类:Na2O2-碱性氧化物 Al2O3-两性氧化物 |
| C、物质的用途:过氧化钠-防毒面具中的供氧剂 氯气-制漂白粉 |
| D、物质的性质:氯化氢-在熔融状态可以导电 浊液-丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发掉0.5L水 |
| B、标况下通入44.8L HCl气体 |
| C、将溶液加热蒸发浓缩至0.5L |
| D、加入10mol/L盐酸0.6L,再将溶液稀释至2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2NaOH═NaCl+NaClO+H2O | ||||
| B、Fe+CuSO4═FeSO4+Cu | ||||
C、2KClO3
| ||||
D、2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
| D、n+1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com