
【题目】能源、环境与生产生活和社会发展密切相关.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 . 相关数据如表:
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH (g)和 |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
①下列情况能说明该反应一定达到平衡状态的是(填字母).
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1c2(填“>”“<”或“=”),a= .
④该温度下反应的平衡常数K=;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)= .
(2)已知反应:2NO2(红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是(填字母). 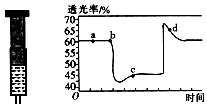
A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc .
【答案】
(1)cd; bd;=;19.6; ![]() (或2.1);0.09mol?L﹣1?s﹣1
(或2.1);0.09mol?L﹣1?s﹣1
(2)B
【解析】解:(1)①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1,
a.反应速率之比等于化学方程式计量数之比为正反应速率之比,v(CO2)消耗=v(CH3OH)生成只能说明反应正向进行,不能说明反应达到平衡状态,故a错误;
b.反应前后气体质量不变,体积不变,气体密度始终不变,气体的密度不再随时间改变,故b错误;
c.CO2和CH3OH的浓度之比不再随时间改变,说明正逆反应速率相同,故c正确;
d.气体质量不变,气体物质的量减小,气体的平均相对分子质量不再随时间改变,说明反应达到平衡状态,故d正确;
所以答案是:cd;
②a.反应为放热反应,降低温度,平衡正向进行,氢气转化率增大,故a不符合;
b.充入更多的H2 会提高二氧化碳的转化率,氢气转化率减小,故b符合;
c.移除甲醇平衡正向进行,氢气转化率增大,故c不符合;
d.增大容器体积,压强减小,平衡逆向进行,氢气转化率减小,故d符合;
所以答案是:bd;
③应用恒温恒容条件下的乙的投料量极端转化为甲相当于投1mol CO2(g)和3mol H2(g),所以两者是等效平衡,所以c1=c2,甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ,则a=49.0kJ﹣29.4kJ=19.6kJ,
所以答案是:=;19.6;
④
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | △H=﹣49.0kJmol﹣1 | |
起始(mol/L) | 1 | 3 | 0 | 0 | 49 kJ |
转化(mol/L) | 0.6 | 1.8 | 0.6 | 0.6 | 29.4 kJ |
平衡(mol/L) | 0.4 | 1.2 | 0.6 | 0.6 |
平衡浓度c(CO2)=0.2mol/L,c(H2)=0.6mol/L,c(CH3OH)=0.3mol/L,c(H2O)=0.3mol/L
K= ![]() =
= ![]() ≈2.1,
≈2.1,
甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)= ![]() =0.09 molL﹣1s﹣1,
=0.09 molL﹣1s﹣1,
所以答案是: ![]() (或2.1);0.09 molL﹣1s﹣1;(2)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A错误;
(或2.1);0.09 molL﹣1s﹣1;(2)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A错误;
B、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故B正确;
C、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故C错误;
D、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故D错误;
所以答案是:B.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 25℃时,pH均为1的盐酸和醋酸加水稀释1000倍,所得溶液的pH:醋酸>盐酸
B. 等体积、等物质的量浓度的NH4HSO4和KOH溶液混合:c(K+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+)
C. 25℃时,pH=12的氨水和pH=2的盐酸等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. 浓度均为0.1 molL-1的HClO溶液和NaClO溶液等体积混合,溶液中有下列关系:c(HC1O)+2c(H+)=c(C1O-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小,且电导率越大溶液的导电能力越强。室温下 ,用0.l00 mol·L-1的NH3· H2O 滴定10 .00mL 浓度均为0 . 100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。下列说法正确的是
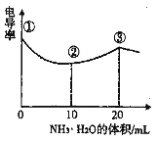
A.① 溶液中c(H +)为0 . 200 mol·L-1
B.溶液温度高低为① >③ >②
C.③ 点后因离子数目减少使电导率略降低
D.③ 点时溶液中有c ( C1一)>(CH3 COO一)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A. 达到化学平衡时,5v正(O2)=4v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 未达到化学平衡时,正反应速率一定不等于逆反应速率
D. 达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1981年,Thoms Cech在研究四膜虫时,发现其rRNA前体加工除去某些片段的过程中发生“剪接反应”,该反应是在仅有RNA没有任何蛋白质参与的情况下完成的。下列推论最合理的是( )
A.该反应不需要酶的催化 B.四膜虫体内的这种RNA具有酶的特性
C.所有蛋白质和RNA都是酶 D.有的DNA也可能是酶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: 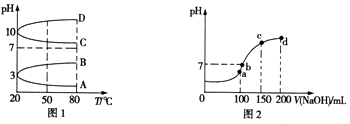
(1)相同条件下,相等浓度的NH4Al(SO4)2溶液中c(NH4+)NH4HSO4溶液中c(NH4+) (填“=”、“>”或“<”).
(2)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象. ①其中符合0.1molL﹣1 NH4Al(SO4)2的pH随温度变化的曲线是(填写字母).
②室温时,0.1molL﹣1 NH4Al(SO4)2溶液中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=molL﹣1(填
计算式).
(3)室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图2所示.图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的顺序是 .
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解质溶液为Na2CO3溶液,电解总反应的方程式为 .
(5)一种可超快充电的新型铝电池,充放电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种气态烃组成的混合物,体积为10ml与过量的氧气混合再充分燃烧,将生成物通过浓H2SO4气体体积减少15ml,再通过碱石灰气体体积又减少20ml [气体体积均为同温(120℃)同压(101kPa)]。混合烃的组成可能为( )
A. C2H6和C2H4 B. C2H4和C2H2 C. CH4和C3H4 D. C4H10和C2H4[来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A.C60与金刚石一样属于原子晶体
B.由非金属元素组成的化合物不一定是共价化合物
C.分子晶体中必含化学键
D.干冰升华破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃下,稀释HA、HB 两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,a点时,HB溶液中B的物质的量分数 ,下列说法正确的是
,下列说法正确的是

A. HA、HB都是弱酸
B. 加水稀释过程中,δ(B )减小
C. NaB溶液中,c(Na+)=c(B-)+c(OH-)
D. 曲线上b、c两点c(B-)/[c(HB)·c(OH-)]相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com