
����Ŀ����Դ����ϡ���Ϣ����Ϊ�ִ���ᷢչ������֧������ѧ����Դ����������ϵ��
(1)�±��е����ݱ�ʾ�ƻ�1mol��ѧ�������ĵ�����(�����ܣ���λΪkJ��mol-1)
��ѧ�� | H-H | Cl-Cl | H-Cl |
���� | 436 | 243 | 431 |
�����������Ϣ��֪��1mol������������������ȼ�������Ȼ�������ų�����___________��
(2)��Ȼ����һ����Ҫ�������Դ�ͻ���ԭ�ϣ�����Ҫ�ɷ�ΪCH4����CH4��������KOH��ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�ء��õ�صĸ�����ӦʽΪ___________��
(3)��ҵ����һ�ַ������� CO2������ȼ�ϼ״������Խ�CO2���Ϊ���������Ϊ1L���ܱ������У�����1molCO2��3molH2��һ�������·�����Ӧ��CO2+3H2![]() CH3OH(g)+H2O(g),���CO2(g)��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ��
CH3OH(g)+H2O(g),���CO2(g)��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ��

�ٴӷ�Ӧ��ʼ��ƽ�⣬CH3OH��ƽ����Ӧ����v(CH3OH)=___________��H2��ת���ʦ�(H2)=___________��
������ӦCO2+3H2![]() CH3OH(g)+H2O(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
CH3OH(g)+H2O(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
A��V(CO2)=0.15mol��L-1��min-1B��V(H2)=0.01mol��L-1��s-1
C��v(CH3OH)=0.2mol��L-1��min-1D��v(H2O)=0.45mol��L-1��min-1
�÷�Ӧ�����ɿ쵽����˳��Ϊ___________(����ĸ)��
(4)��ˮ��ѧ��Դ�����þ��зdz�������ǰ�����Ӻ�ˮ����ȡ��Ĺ�ҵ������ͼ��

�����̢����漰�����ӷ�Ӧ���£��������淽���������ʵ��Ļ�ѧ��������
��Br2+��CO32-=��BrO3-+��Br-+��CO2��______
����������������漰������ԭ��Ӧ����___________����
�۲�������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ����___________��
���𰸡� 183kJ CH4-8e-+10OH-=CO32-+7H2O 0.075mol/��Lmin�� 75% D��C=B��A����D��B = C��A�� 3 3 1 5 3 4 ��������Ũ������Ԫ��
��������(1)�����ʱ�H=��Ӧ������ܺ�-����������ܺͽ��м��㡣
(2) ���顢����������������Һ�γ�ԭ���,��������ʧ���ӷ���������Ӧ��
(3)�ٸ���ͼ����Ϣ����������ʽ���н��
���������ʵ����ʳ��Ը����ʵ�����Ӧ��ϵ����Ȼ��Ƚϸ����ʵ����ʵ���ֵ��С��ע�ⵥλҪͳһ��
(4) �����ݻ��ϼ۵�����������غ������ƽ��
�� ����ˮɹ�����������仯����������ڵ��Ȼ��ƿ�����������������������ԭ��Ӧ���������������������ɵ�����������������ԭ��Ӧ��������̼������Һ����������ԭ��Ӧ3Br2��3CO32��=BrO3����5Br����3CO2��������������ԭ��Ӧ�����������������������ӱ�����Ϊ�嵥��������������ԭ��Ӧ�������Ϸ������
����ˮ����Ԫ�ص�Ũ�ȵͣ����II�������Ǹ�����Ԫ����
(1)��ӦH2(g)+Cl2(g)=2HCl(g),�ʱ�H=��Ӧ������ܺ�-����������ܺ�=436+243-2��431=-183 kJ�����Ȼ�ѧ����ʽΪ: H2(g)+Cl2(g)=2HCl(g) H=-183 kJ��mol-1,1mol������������������ȼ�������Ȼ�������ų�����183kJ����ȷ����183kJ��
(2) ���顢����������������Һ�γ�ԭ���,��������ʧ���ӷ���������Ӧ,��ӦʽΪ: CH4-8e-+10OH-=CO32-+7H2O ����ȷ��: CH4-8e-+10OH-=CO32-+7H2O��
(3)�ٸ���ͼ���֪����Ӧ�ﵽƽ��ʱ��������̼��Ũ�ȱ仯��1-0.25=0.75mol/L���״���Ũ�ȱ仯��0.75mol/L��CH3OH��ƽ����Ӧ����v(CH3OH)=0.75/10= 0.075mol/��Lmin�������ݷ�Ӧ��ϵ��֪��������Ũ�ȱ仯��0.75��3=2.25 mol/L���仯����Ϊ2.25��1=2.25mol��H2��ת���ʦ�(H2)= 2.25/3��100%=75%����ȷ����0.075mol/��Lmin����75% ��
���������ʵ����ʳ��Ը���������Ӧ��ϵ����Ȼ��Ƚϸ����ʵ����ʵ���ֵ����A��V(CO2)=0.15mol��L-1��min-1��B��V(H2)= 0.01��60/3=0.2 mol��L-1��min-1��C��v(CH3OH)=0.2mol��L-1��min-1��D��v(H2O)= 0.45/1=0.45 mol��L-1��min-1���÷�Ӧ�����ɿ쵽����˳��ΪD��C=B��A����ȷ����D��C=B��A����D��B = C��A����
(4) �����ݻ��ϼ۵�������ƽ����3Br2��CO32����BrO3����5Br�����ڣ����÷�Ӧǰ������������غ㣬��ƽCO32������Ϊ3Br2��3CO32����BrO3����5Br�����ڣ�����Ԫ���غ��ԭ�Ӹ����غ㣬��Ϊ3Br2��3CO32��=BrO3����5Br����3CO2������ȷ����3�� 3�� 1�� 5�� 3��
�� ����ˮɹ�����������仯����������ڵ��Ȼ��ƿ�����������������������ԭ��Ӧ���������������������ɵ�����������������ԭ��Ӧ��������̼������Һ������ӦΪ��3Br2��3CO32��=BrO3����5Br����3CO2��������������ԭ��Ӧ�����������������������ӱ�����Ϊ�嵥��������������ԭ��Ӧ����������������漰������ԭ��Ӧ����4������ȷ�𰸣�4��
����ˮ����Ԫ�ص�Ũ�ȵͣ����II�������Ǹ�����Ԫ�أ���ȷ������������Ũ������Ԫ����


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(���� )
A. ����Խ�÷���Խ�ȶ�
B. ���ۼ��ļ���Խ���ۼ�Խ�ι̣����иü��ķ���Խ�ȶ�
C. CH4��CCl4�м�����ȣ����Dz�ͬ
D. C===C���ļ�����C��C����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ�����У�������KMnO4����Һ������KMnO4�����������²�̫�ȶ����������ֱ������ȷ���ʵ���Ũ�ȵ�KMnO4��Һ��ʵ����һ���ȳ�ȡһ��������KMnO4���壬��ɴ���Ũ�ȵ�KMnO4��Һ�����������ȶ�����Է��������ϴ�Ļ����ʲ�����[Mr��Na2C2O4��=134.0]�����Ƶ�KMnO4��Һ���б궨����������Ƶ�KMnO4��Һ��ȷŨ�ȣ���Ӧԭ��Ϊ��5C2O42��+2MnO4��+16H+�T10CO2��+2Mn2++8H2O
�����DZ궨KMnO4��Һ��ʵ�鲽�裺
����һ��������Ũ��ԼΪ0.10molL��1�ĸ��������Һ500mL��
�������ȡ0.02molL��1 ��Na2C2O420.00mL������ƿ�У�����ϡ�����ữ���ò���һ������������Һ���еζ�������ƽ��ʵ������ݼ�¼�ڱ��У�
ƽ��ʵ���� | Na2C2O4��Һ | �ζ�����ʼ������mL�� | �ζ��ܵζ��յ������mL�� |
�� | 20.00 | 0.00 | 21.18 |
�� | 20.00 | 1.02 | 21.00 |
�� | 20.00 | 1.18 | 21.20 |
�Իش��������⣺
��1������һ��Ҫ�õ�����Ҫ���������dz��ձ������������ ��
��2��������еζ�����ѡ���ζ��ܣ����ʽ����ʽ�����ζ��յ���жϷ�����
��3�������ζ������ᵼ�²������ƫ�ߵ���
A.�ζ��ܵζ�ǰ�����ݣ��ζ���������ʧ
B.��ƿϴ�Ӻ�û�и���
C.�ζ��յ�ʱ������ʱ����
D.�ζ�ʱ��ƿ����Һ�彦��
E.һ�θ��������Һ������ƿ����δ����
��4����ʵ���������ݼ��㣬KMnO4��Һ��Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������,��10mL0.2mol/LH2C2O4��Һ�еμ�0.2mol/LKOH��Һ��ˮ�����������Ũ��c(H+)���������������Һ������ı仯����ͼ,��֪������,H2C2O4�ĵ��볣��Ϊ��K1=5.0��10-2��K2=5.4��10-5,����ͼʾ�жϣ�����˵������ȷ���ǣ� ��

A. c�����Һ�Լ���
B. a��ʱ,����KOH��Һ�����V1=10mL
C. b��ʱ,��Һ�и�����Ũ�ȵĴ�С˳��Ϊ��c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
D. ��V(KOH)=15mLʱ,��Һ�д������¹�ϵ��2c(K+)=3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ϊ��ѹ��������Ϊ������������ͬ�����³�������ʵ�����NO2���壬����ʼʱ�����ͬ��������Ӧ��2NO2��g��N2O4 ��g����H��0��һ��ʱ�����̴ﵽƽ��״̬������˵������ȷ���ǣ�������
A.ƽ��ʱNO2����������ף���
B.�ﵽƽ������ʱ�䣬���������
C.�÷�Ӧ��ƽ�ⳣ������ʽK=c��N2O4��/c��NO2��
D.���������������ѹǿ���ֲ��䣬��˵����Ӧ�Ѵﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ƕ���(C4H10)�ѽ��ʵ�����̡����Ӻ�װ�ú�����е�ʵ������У��ټ�������װ�õ������Ԣ��ų�װ���еĿ����۸�D��Gװ�ü��ȵȡ�����G����װ���Լ�����̨����ʡ�ԣ�CuO�ܽ���������CO2��H2O��

��ش��������⣺
(1)�����ѽ�Ŀ��ܷ���ʽΪC4H10![]() CH4+C3H6��____________________��
CH4+C3H6��____________________��
(2)д������������ͭ��Ӧ�Ļ�ѧ����ʽ_____________________________��
(3)���Է�Ӧ��Eװ���еĻ����(��ˮ����),�ٰ���������ʵ�飺
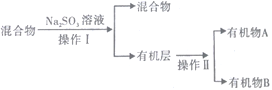
�ٷ��������͢�����Ʒֱ���___________��___________(����ĸ) ��
a������ b������ c����Һ d������
��Na2SO3��Һ��������(�����ӷ���ʽ��ʾ)_____________________________________________��
����֪A��̼ԭ��������B��̼ԭ��������д��B������______________________��
(4)�ٶ�������ȫ�ѽ⣬����D��Gװ���е���������ȫ��Ӧ����(E+F)װ�õ��������ȷ�Ӧǰ������0.49g��Gװ�õ������ȷ�Ӧ�������1.44��������ѽ�����м������������ʵ���֮��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǰú̿���ҹ�����Դ������ռ60%���ϣ����ڸ������ṩ������Դ��ͬʱ��ȼ�����ɵ�SO2��NOx��Ҳ����˱Ƚ����صĴ�����Ⱦ���⡣
(1)��ȼú�м���CaO��ú����Ԫ�ش������ת��ΪCaSO4����CaO��������SO2�ŷ��������á�
��֪����SO2(g)+CaO(s)=CaSO3(s) ��H=-402kJ��mol-1
��2CaSO3(s)+O2(g)=2CaSO4(s) ��H =-234.2 kJ��mol-1
��CaCO3(s)=CO2(g)+CaO(s) ��H=+178.2 kJ��mol-1
��Ӧ2SO2(g)+O2(g)+2CaO(s)=2CuSO4(s) ��H =________kJ��mol-1��
��ȼú�м���CaCO3Ҳ���������ã����̶�2molSO2����Ӧ����ú����ͬ������ȼ��ʱ���ͷų������������______________kJ��
(2)����̿��NO2�н�ǿ�������ԣ�����֮��ɷ���2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ��H��Ϊ�о��¶ȡ�ѹǿ���ⲿ���ضԸ÷�Ӧ��Ӱ�죬ij����С�����ܱ������м���2molNO2�������Ļ���̿����������ʵ��̽����
N2(g)+2CO2(g) ��H��Ϊ�о��¶ȡ�ѹǿ���ⲿ���ضԸ÷�Ӧ��Ӱ�죬ij����С�����ܱ������м���2molNO2�������Ļ���̿����������ʵ��̽����
i.�̶��ܱ����������Ϊ5L����ú���ʱ��ͬ�¶���NO2��ת����(��)��ʱ��(t)�Ĺ�ϵ��ͼ1��ʾ��

�ٸ÷�Ӧ�ġ�H_________0�>����<��)���¶�ΪT2ʱ����Ӧ��ʼ���ﵽƽ���ʱ�����v(N2)=_____________��
���¶�ΪT1ʱ�÷�Ӧ��ƽ�ⳣ��K=________���������¶Ȳ��䣬���NO2ת���ʵķ�����___________��
��.���������е��¶Ⱥ㶨�����20sʱ��CO2���������(��)��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��

��ͼ�����߳�����������ı仯���ƣ���ԭ��Ϊ______________________��ѹǿΪp1ʱ����20sʱ������c(NO2)��c(N2)=_______________��
(3)�����£���NaOH��Һ����SO2�ȿ�������������Ⱦ���ֿɻ����Ҫ�Ļ�����Ʒ����ij����Һ��c(HSO3-)��c(SO32-)=1��100���������ܱ���pH=____________(������K1(H2SO3)=1.5��10-2��K2(H2SO3)=1��10-7)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����()
A.Ħ�������ʵ����ĵ�λB.2molˮ��Ħ������36g/mol
C.�����ӵ�������12g̼��������̼ԭ����D.�����ӵ���������ΪNA��ͨ����6.02��1023��ʾ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com