
| A. | 同周期ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第3周期元素的离子半径从左到右逐渐减小 |
分析 A.同周期从左到右金属性减弱;
B.半径越小最外层电子受原子核的吸力越大;
C.非金属性越强,最高价氧化物对应的水化物的酸性越强;
D.第三周期中,阴离子半径大于阳离子半径,具有相同排布的离子原子序数大的离子半径小.
解答 解:A.同周期从左到右金属性减弱,所以同周期ⅠA族元素的金属性比ⅡA族元素的金属性强,故A正确;
B半径越小最外层电子受原子核的吸力越大,所以越难失电子,故B错误;
C.非金属性越强,最高价氧化物对应的水化物的酸性越强,则同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强,而HClO、亚硫酸等为弱酸,但不是最高价含氧酸,故C错误;
D.第三周期中,阴离子半径大于阳离子半径,具有相同排布的离子原子序数大的离子半径小,如第三周期中铝离子半径最小,故D错误;
故选A.
点评 本题考查元素的性质,为高频考点,把握元素的位置及性质变化规律为解答的关键,把握元素金属性、非金属性比较即可解答,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
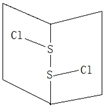 S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )| A. | 与S2Br2结构相似,熔沸点S2Br2>S2Cl2 | |
| B. | 分子中既含有极性键又含有非极性键 | |
| C. | 与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| D. | 为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
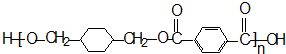
 -CH3+Cl2→
-CH3+Cl2→ -CH2Cl+HCl
-CH2Cl+HCl
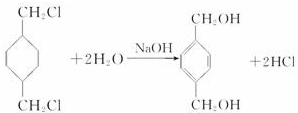
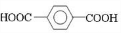 +
+ $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$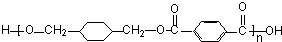 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①⑤ | B. | ①②③④的混合物 | C. | 只有②⑤ | D. | ①②③④⑤的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | D>B>A>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com