
KClO3分解时尚有副反应,导致收集到的气体有异味.据推测,副产物可能是O3、Cl2、ClO2中的一种或几种.资料表明:O3、Cl2、ClO2的沸点依次为﹣111℃、﹣34℃和11℃,且O3、ClO2也能将KI氧化为I2.为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入如装置进行实验:
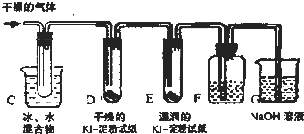
(1)若要确认副产物中含Cl2,F中应盛放 溶液.
(2)确定副产物中含有ClO2的现象是 .
(3)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有臭氧的结论?
答: (填“能”或“不能”).理由是 .
| 探究物质的组成或测量物质的含量;实验装置综合.. | |
| 专题: | 实验设计题. |
| 分析: | 由实验装置可知,干燥气体利用冰水冷却,ClO2转化为液体,D中无现象,E中KI被氧化后淀粉变蓝,F中加硝酸银生成白色沉淀可说明存在氯气,G中NaOH为尾气处理装置. (1)确认副产物中含Cl2,利用氯气和水反应生成盐酸和次氯酸,加入硝酸银溶液生成白色沉淀证明含有氯气; (2)ClO2的沸点11℃,冷却变化为液态,确定副产物中含有ClO2的现象是装置C中有液体生成; (3)实验时若D中无现象,E中试纸变蓝,说明气体中含有氧化性的气体,O3、氯气都具有强氧化性. |
| 解答: | 解:由实验装置可知,干燥气体利用冰水冷却,ClO2转化为液体,D中无现象,E中KI被氧化后淀粉变蓝,F中加硝酸银生成白色沉淀可说明存在氯气,G中NaOH为尾气处理装置. (1)利用氯气和水反应生成盐酸和次氯酸,加入硝酸银溶液生成白色沉淀证明含有氯气,若要确认副产物中含Cl2,F中应盛放硝酸银溶液,故答案为:AgNO3溶液; (2)ClO2的沸点11℃,冷却会变化为液态,所以确定副产物中含有ClO2的现象是C装置试管中有液体生成,故答案为:C装置试管中有液体生成; (3)实验时若D中无现象,E中试纸变蓝,说明气体中含有氧化性的气体,O3、氯气都具有强氧化性,所以上述现象不能说明副产物含有O3的结论,氯气也可以银行碘化钾生成碘单质, 故答案为:不能;Cl2也可以氧化KI产生I2. |
| 点评: | 本题考查混合气体的组成测定及实验方案设计,为高频考点,把握信息及实验装置的作用为解答的关键,注意沸点应用及氯气、臭氧均具有氧化性,题目难度中等. |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是( )

A.原子半径X<Y
B.最高价氧化物对应的水化物酸性X>Y
C.X的氢化物具有强还原性
D.Y与碘同周期,Y的最高价氧化物对应的水化物的酸性比高碘酸(HIO4)强
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式分别为:
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3kJ·mol-1,
H2O(l)===H2O(g) ΔH=+44kJ·mol-1;
则356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷
气体完全燃烧生成液态水,放出的热量为________。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为_________________________________________________________;
(3)家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧反应的热化学方程式___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的镁和铝混合均匀后,分为等量的四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
|
| A. | 3 mol•L﹣1HCl溶液 | B. | 3 mol•L﹣1HNO3溶液 |
|
| C. | 8 mol•L﹣1NaOH溶液 | D. | 18 mol•L﹣1浓H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的NaHCO3分为三等份,第一份直接加入盐酸中,消耗盐酸物质的量为n1,第二份首先加热,使其部分分解后,再加入盐酸中,消耗盐酸物质的量为n2,第三份首先加热,使其完全分解后,再加入盐酸中,消耗盐酸物质的量为n3,假若与盐酸都完全反应,则n1、n2、n3的大小关系正确的是( )
|
| A. | n1=n2=n3 | B. | n2>n1>n3 | C. | n1>n2>n3 | D. | n1>n3>n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体
B.二氧化硫具有漂白性,可用于加工食品使食品增白
C.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料
D.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物种类最多的元素,且X常见化合价为+1和-1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述不正确的是
A.原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X)
B.元素Y的简单气态氢化物的热稳定性比W的弱
C.化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂
D.由X、Y、Z、W四种元素组成的化合物其水溶液可能显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色)。则下列说法不正确的是( )

A.甲区呈现红色 B.乙区产生Zn2+
C.丙区发生的电极反应式:Cu-2e-= Cu2+ D.丁区呈现蓝色

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com