
【题目】某溶液中FeCl3的水解反应已达平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
A. 加入NaHCO3B. 加入AgNO3固体
C. 加入FeCl3固体D. 降温
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是
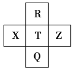
A.气态氢化物的酸性:R>T>Q
B.R与Q的电子数相差16
C.气态氢化物的稳定性:T>X
D.R的单质通入T的钠盐溶液中能置换出T的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是
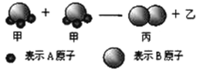
A.1个乙分子中含有2个A原子
B.该反应类型是分解反应
C.相对分子质量:Mr(甲)=Mr(乙)+Mr(丙)
D.该反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为
在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为![]() ,另有少量Pb、
,另有少量Pb、![]() 和
和![]() 等)为原料制备
等)为原料制备![]() 的一种工艺流程如图所示:
的一种工艺流程如图所示:
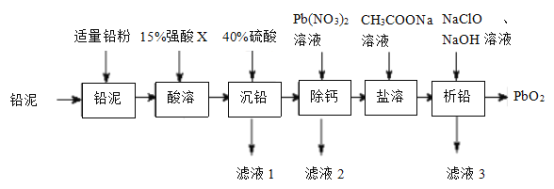
已知:i.常温下,单质铅与盐酸或硫酸几乎都不反应。
ii.铅盐中,(CH3COO)2Pb、Pb(NO3)2均易溶于水,![]() 难溶于水。
难溶于水。
请回答下列问题:
(1)“酸溶”时,Pb和PbO2转化为可溶性Pb2+盐,则“酸溶”时所用的强酸X为____;此条件下的氧化性:X___PbO2(选填“>”或“<”)
(2)用Pb(NO3)2溶液反复多次洗涤沉淀,以达到“除钙”的目的,其原理是_____________。
(3)(CH3COO)2Pb属于__________(选填“强电解质”或“弱电解质”);“滤液3”中除CH3COONa和NaClO外,所含钠盐主要还有___________(填化学式)
(4)“析铅”反应的离子方程式为____________________。
(5)从环境保护的角度分析,该工艺流程可能存在的缺点是_______________(任写一条)
(6)铅蓄电池中的电解液是H2SO4,放电后两个电极上均沉积有PbSO4。则放电时的负极反应式为___;充电时当电极上通过1mol电子,阳极的质量减少__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:
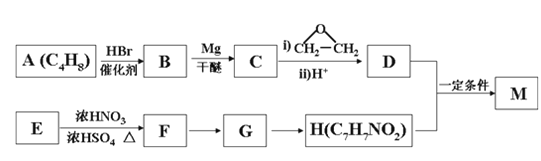
已知以下信息:①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
②RX![]() RMgX
RMgX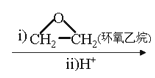 RCH2CH2OH。
RCH2CH2OH。
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是_____________________。
(2)由E生成F的化学方程式为_________________________________________。
(3)由G生成H的反应类型为__________________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式_______________________________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_____种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式___。
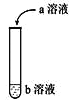
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ||
稀盐酸 | Na2CO3 |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:___。
NaIO3+NaHSO3=I2+Na2SO4+H2SO4+H2O
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。如图是制备高铁酸钾的一种装置,制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是( )
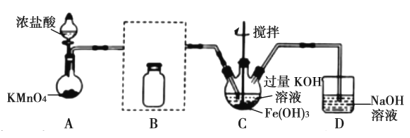
A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝等特点为一体的优良的水处理剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钾是―种白色粉末,极易溶于冷水,遇热水则分解,在空气中极不稳定,受热后迅速自行分解。工业上生产次氯酸押的流程如下:
![]()
下列说法正确的是
A. 步骤Ⅰ、Ⅱ发生的反应均为非氧化还原反应
B. 步骤Ⅱ采取的方法是加入足量水以制得Ca(OH)2溶液
C. 步骤Ⅲ氧化时,氯气是氧化剂,Ca(OH)2是还原剂
D. 步骤Ⅵ的操作包括蒸发浓缩,冷却结晶、在空气中晾干
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com