
����Ŀ��������������ѧ�����ش��������⣺
��1���ð״��ݿ�ˮ�����ڶ��췢�ֺ���ˮ����ʧ����ˮ���ֹ�������ˣ�ˮ������Ҫ�ɷ���̼��Ƶȣ��������ӷ�Ӧ����ʽΪ____________��
��2��ʳ�β�����������Ȼ���Ļ����ϣ��۲쵽��������_____���ñ仯��Ϊ_____��Ӧ��
��3��մ��ˮ�����������ڸ��»����ϻᷢ�ڣ��÷�Ӧ�Ļ�ѧ����ʽ��____________��
��4�����������ʱ�����С�մ���������Ȳ�����������ʣ��ɽ�С�մ���Ϊ���ɼ����÷�Ӧ�Ļ�ѧ����ʽ��________________��
��5�����ά��ɳ�ӡ�ʯӢ����觵���Ҫ�ɷ���__________���ѧʽ����
��6��������Ŀ�ĵ�������__________�������ƣ��Բ������п�ʴ���Ƴɵġ�
��7��ʹ�á�84������Һ����NaClO��ʱ����һ������������ˮ��ϣ����ڿ����н���һ��ʱ�䣬ʹNaClO��H2O�������е�CO2��ַ�Ӧ���Դﵽɱ��������Ч�����õ�Ŀ�ġ����÷�Ӧ�����ӷ���ʽ����������![]() ____+____��
____+____��
���𰸡�![]() �����ɻ�ɫ ��ɫ
�����ɻ�ɫ ��ɫ ![]()
![]()
![]() ��(3Fe+2O2
��(3Fe+2O2![]() Fe3O4)
Fe3O4) ![]()
![]()
![]() SiO2 ����� HClO HCO3��
SiO2 ����� HClO HCO3��
��������
��(1)������ӦΪCaCO3+2CH3COOH�T(CH3COO)2Ca+H2O+CO2���������ӷ�ӦΪCaCO3+2CH3COOH�TCa2++2CH3COO��+H2O+CO2����
�ʴ�Ϊ��CaCO3+2CH3COOH�TCa2++2CH3COO��+H2O+CO2����
(2)ʳ�β�����������Ȼ���Ļ����ϣ��۲쵽�������ǻ����ɻ�ɫ���ñ仯��Ϊ��ɫ��Ӧ��
�ʴ�Ϊ�������ɻ�ɫ����ɫ��
(3)մ��ˮ�����������ڸ��»����ϻᷢ�ڣ��÷�Ӧ�Ļ�ѧ����ʽ��3Fe+4H2O(g)![]() Fe3O4+4H2���ʴ�Ϊ��3Fe+4H2O(g)
Fe3O4+4H2���ʴ�Ϊ��3Fe+4H2O(g)![]() Fe3O4+4H2��
Fe3O4+4H2��
(4)���������ʱ�����С�մ���������Ȳ�����������ʣ��ɽ�С�մ���Ϊ���ɼ����÷�Ӧ�Ļ�ѧ����ʽ��2NaHCO3![]() Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
(5)���ά��ɳ�ӡ�ʯӢ����觵���Ҫ�ɷ���SiO2���ʴ�Ϊ��SiO2��
(6)������Ŀ�ĵ������������Բ������п�ʴ���Ƴɵģ��ʴ�Ϊ������
(7)ʹ����84������Һ(��NaClO)ʱ����һ������������ˮ��ϣ����ڿ����н���һ��ʱ�䣬ʹNaClO��H2O�������е�CO2��ַ�Ӧ���Դﵽɱ��������Ч�����õ�Ŀ�ģ��ɵ���غ㼰ԭ���غ��֪�÷�Ӧ�����ӷ���ʽΪClO��+CO2+H2O=HClO+HCO3�����ʴ�Ϊ��HClO��HCO3����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʮ�����ʣ���HCl����NaHCO3����K2SO4��Һ����SiO2�������Ǿ��壻��NaOH���������������壻��NH3��H2O�����������Al2(SO4)3
��1���������������ڵ���ʵ���____(�����)���������ε�������Ģٵ�ˮ��Һ�����ֵ�ʵ��������___��
��2���â���ޱ����Ʊ������ƣ��ɲ���ͼ�е�װ��Ϊ____����ѡ���ţ���
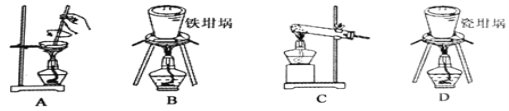
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������amol FeBr2����Һ�У�ͨ��xmol Cl2�����и���ΪͨCl2�����У���Һ�ڷ�����Ӧ�����ӷ���ʽ�����в���ȷ����(����)
A.x��0.4a��2Fe2����Cl2=2Fe3����2Cl��
B.x��0.6a��10Fe2��+2Br����6Cl2=Br2��12Cl��+10Fe3��
C.x��a��Fe2����2Br����2Cl2=Br2��Fe3����4Cl��
D.x��1.5a��2Fe2����4Br����3Cl2=2Br2��2Fe3����6Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�ܱ������д��ڿ��淴Ӧ2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g) ��H���������������ͬʱ��CO��ƽ��ת���������¶�(T)��ѹǿ(p)�ı仯��ͼ1��������ʾ�� ƽ�ⳣ��K���¶ȹ�ϵ��ͼ2��ʾ��
�ش��������⣺
ͼ1 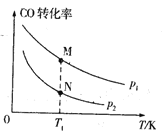 ͼ2
ͼ2 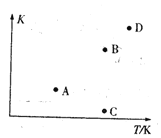
(1)�÷�Ӧ����H___0(��������������������ͬ����pl____p2��M��N��ȣ��������ƽ����Է��������ϴ����____��
(2) A��B, C��D�ĵ�������ȷ��ʾ�÷�Ӧ��ƽ�ⳣ�����¶�T�Ĺ�ϵ�ĵ�Ϊ_____��
(3)���и��������ܱ���һ���¶��£������ܱ������з�Ӧ2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)�ﵽƽ��״̬����___��
a.�����ܶȱ��ֲ��� b.��Ӧ������ c(CO):c(H2)=1:2
c.�������ʣ�v(CO)=2v(H2O) d. ��H����
(4)���ں��������£������������ͨ��1 mol CO��2 mol H2�����ʵ��������¶���ʹ�䷢����Ӧ2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)����ÿ�ʼʱ������ѹΪ 3xl05Pa����Ӧ��2 min�ﵽƽ����ƽ��ʱ��ϵѹǿ������![]() ����v(CO)= ____Pa/min�����¶��µ�ƽ�ⳣ��ΪKp��ֵΪ____��
����v(CO)= ____Pa/min�����¶��µ�ƽ�ⳣ��ΪKp��ֵΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը����Ϊԭ�ϣ��绯ѧ���Ʊ��ظ���ص�ʵ��װ��ʾ��ͼ��ͼ������˵������ȷ���ǣ� ��

A.�������ң������ĵ缫��ӦΪ��2H2O��2e-=2OH-��H2��
B.�������ң�ͨ�����Һ���ɻ�ɫ��Ϊ��ɫ������Ϊ������H��Ũ������ʹƽ��2CrO42-+2H+![]() Cr2O72-��H2O�����ƶ�
Cr2O72-��H2O�����ƶ�
C.���Ʊ������ܷ�Ӧ�Ļ�ѧ����ʽΪ��4K2CrO4��4H2O![]() 2K2Cr2O7��4KOH��2H2����O2��
2K2Cr2O7��4KOH��2H2����O2��
D.�ⶨ����Һ��K��Cr�ĺ�������K��Cr�����ʵ���֮��Ϊd�����ʱ����ص�ת����Ϊ1��0.5d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ȷ���ǣ�������
A.�ɷ�Ӧ��M(s)+N(g) ![]() R(g) ��H1 ��M(g)+N(g)
R(g) ��H1 ��M(g)+N(g) ![]() R(g) ��H2����H 2����H 1
R(g) ��H2����H 2����H 1
B.��֪��2SO2(g)+O2(g) ![]() 2SO3(g)����H=��98.3kJ/mol����1molSO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
2SO3(g)����H=��98.3kJ/mol����1molSO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
C.��⾫��ͭʱ����Դ�����봿ͭ�������ҵ������ҺŨ��ʼ�ձ��ֲ���
D.�ö��Ե缫��� Na2SO4��Һ������������1mol����ʱ���ɼ�18 g ˮʹ��Һ�ָ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ������ij�෴Ӧ[aA(g)+bB(g)cC(g)]�Ļ�ѧƽ���Ӱ�죬�õ�ͼ��(ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ʾת����)
��Ӧ��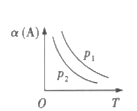 ��Ӧ��
��Ӧ��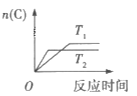
����ͼ�ش��������⣺
(1)�ڷ�ӦI�У���![]() >
>![]() ����÷�Ӧ������ӦΪ__________(��������������������)��Ӧ����Ϊ���������__________(������С������������)�ķ�Ӧ;���˷�Ӧ���Է����У�����������������__________
����÷�Ӧ������ӦΪ__________(��������������������)��Ӧ����Ϊ���������__________(������С������������)�ķ�Ӧ;���˷�Ӧ���Է����У�����������������__________
(2)�ڷ�ӦII�У�![]() __________(�>������<����=��)
__________(�>������<����=��)![]() ���÷�Ӧ������ӦΪ__________(��������������������)��Ӧ��
���÷�Ӧ������ӦΪ__________(��������������������)��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ���Ͻ�����100mLϡ�����У�����1.12LNO����(��״��)����Ӧ�����Һ�м���NaOH��Һ����������������������������mL�������ͼ��ʾ������˵������ȷ���ǣ� ��

A.ԭ��Һ��c��HNO3��=1.8mol/LB.�����������Ϊ4.08g
C.n��Mg����n��Al��=1:1D.����������ҺŨ��Ϊ3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH��Ϊ2�������ΪV0��HA��HB��HC��Һ���ֱ��ˮϡ�������ΪV����ҺpH��lg![]() �ı仯��ϵ��ͼ��ʾ����������������ǣ� ��
�ı仯��ϵ��ͼ��ʾ����������������ǣ� ��
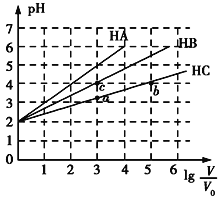
A.�����£�Ka(HB)>Ka(HC)
B.HC�ĵ���ȣ�a��<b��
C.��lg![]() =4ʱ��������Һͬʱ�����¶ȣ�
=4ʱ��������Һͬʱ�����¶ȣ�![]() ��С
��С
D.��lg![]() =5ʱ��HA��Һ��pHΪ7
=5ʱ��HA��Һ��pHΪ7
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com