
ЃЈ17ЗжЃЉH2O2ЪЧвЛжжТЬЩЋбѕЛЏЛЙдЪдМСЃЌдкЛЏбЇбаОПжагІгУЙуЗКЁЃ
ЃЈ1ЃЉФГаЁзщФтдкЭЌХЈЖШFe3+ЕФДпЛЏЯТЃЌЬНОПH2O2ХЈЖШЖдH2O2ЗжНтЗДгІЫйТЪЕФгАЯьЁЃЯобЁЪдМСгывЧЦїЃК30% H2O2ЁЂ0.1mol?L-1Fe2(SO4)3ЁЂеєСѓЫЎЁЂзЖаЮЦПЁЂЫЋПзШћЁЂЫЎВлЁЂНКЙмЁЂВЃСЇЕМЙмЁЂСПЭВЁЂУыБэЁЂКуЮТЫЎдЁВлЁЂзЂЩфЦї
ЂйаДГіБОЪЕбщH2O2ЗжНтЗДгІЗНГЬЪНВЂБъУїЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЃК____________
ЂкЩшМЦЪЕбщЗНАИЃКдкВЛЭЌH2O2ХЈЖШЯТЃЌВтЖЈ ____________________________________ЃЈвЊЧѓЫљВтЕУЕФЪ§ОнФмжБНгЬхЯжЗДгІЫйТЪДѓаЁЃЉЁЃ
ЂлЩшМЦЪЕбщзАжУЃЌЭъГЩЯТЭМЕФзАжУЪОвтЭМЁЃ
ЂмВЮееЯТБэИёЪНЃЌФтЖЈЪЕбщБэИёЃЌЭъећЬхЯжЪЕбщЗНАИЃЈСаГіЫљбЁЪдМСЬхЛ§ЁЂашМЧТМЕФД§ВтЮяРэСПКЭЫљФтЖЈЕФЪ§ОнЃЛЪ§ОнгУзжФИБэЪОЃЉЁЃ
ЃЈ2ЃЉРћгУЭМ21ЃЈaЃЉКЭ21ЃЈbЃЉжаЕФаХЯЂЃЌАДЭМ21ЃЈcЃЉзАжУЃЈСЌФмЕФAЁЂBЦПжавбГфгаNO2ЦјЬхЃЉНјааЪЕбщЁЃПЩЙлВьЕНBЦПжаЦјЬхбеЩЋБШAЦПжаЕФ_________ЃЈЬюЁАЩюЁБЛђЁАЧГЁБЃЉЃЌЦфдвђЪЧ______________________________________________________ЁЃ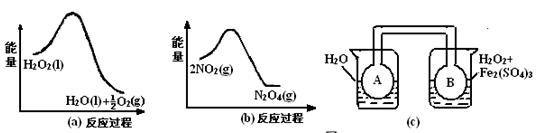
ЃЈ1ЃЉЂй
ЂкЩњГЩЯрЭЌЬхЛ§ЕФбѕЦјЫљашЕФЪБМф
Ђл
ЂмВтЖЈЗДгІЪБМф
ЃЈ2ЃЉЩюЃЛвђЮЊЙ§бѕЛЏЧтЗжНтЪЧЗХШШЗДгІЃЌ2NO2(g) H2O2ЕФЬхЛ§(mL) 0.1mol?L-1Fe2(SO4)3ЕФЬхЛ§ЃЈmLЃЉ МгШыеєСѓЫЎЕФЬхЛ§ЃЈmLЃЉ ЩњГЩO2ЕФЬхЛ§(mL) ЗДгІЪБМфЃЈminЃЉ ЪЕбщ1 b a c d ЪЕбщ2 c a b d 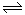 N2O4(g)вВЪЧЗХШШЗДгІЃЌЫљвдBЦПЮТЖШИпгкAЦПЃЌЮТЖШЩ§ИпЃЌЦНКтФцЯђвЦЖЏЃЌЖўбѕЛЏЕЊХЈЖШдіДѓЃЌбеЩЋМгЩюЁЃ
N2O4(g)вВЪЧЗХШШЗДгІЃЌЫљвдBЦПЮТЖШИпгкAЦПЃЌЮТЖШЩ§ИпЃЌЦНКтФцЯђвЦЖЏЃЌЖўбѕЛЏЕЊХЈЖШдіДѓЃЌбеЩЋМгЩюЁЃ
НтЮіЪдЬтЗжЮіЃКЃЈ1ЃЉЂйЙ§бѕЛЏЧтдкСђЫсЬњзїДпЛЏМСЬѕМўЯТЗжНтЩњГЩЫЎКЭбѕЦјЃЌЙ§бѕЛЏЧтМШзїбѕЛЏМСгжзїЛЙдМСЃЌЛЏбЇЗНГЬЪНМАЕчзгзЊвЦЗНЯђКЭЪ§ФПЮЊ
ЂкЗДгІЫйТЪЪЧЕЅЮЛЪБМфФкЮяжЪХЈЖШЕФИФБфСПЃЌЫљвдВтЖЈВЛЭЌХЈЖШЕФЙ§бѕЛЏЧтЖдЗжНтЫйТЪЕФгАЯьЃЌашВтЖЈЯрЭЌЪБМфФкЃЌВњЩњбѕЦјЕФЬхЛ§ЕФЖрЩйЃЌЛђЩњГЩЯрЭЌЬхЛ§ЕФбѕЦјЫљашЪБМфЕФЖрЩйЃЛ
ЂлРћгУХХЫЎСПЦјЗЈЃЌЪеМЏвЛЖЈЬхЛ§ЕФO2ЃЌашвЊЫЎВлЁЂСПЭВЁЂЕМЦјЙмЃЌСПЭВФкЪЂТњЫЎЕЙПлдкЫЎВлжаЃЌзАжУШчЭМ
Ђм
ЃЈ2ЃЉгЩЭМaПЩжЊЙ§бѕЛЏЧтЕФЗжНтЗДгІЪЧЗХШШЗДгІЃЌгЩЭМbПЩжЊЖўбѕЛЏЕЊзЊЛЏЮЊЫФбѕЛЏЖўЕЊЕФЗДгІвВЪЧЗХШШЗДгІЃЌЫљвдзАжУcжаЃЌгвВрЩеБBЦПЮТЖШИпгкзѓВрЩеБAЦПЃЌЖјЮТЖШЩ§ИпЃЌЪЙЦНКт2NO2(g) H2O2ЕФЬхЛ§(mL) 0.1mol?L-1Fe2(SO4)3ЕФЬхЛ§ЃЈmLЃЉ МгШыеєСѓЫЎЕФЬхЛ§ЃЈmLЃЉ ЩњГЩO2ЕФЬхЛ§(mL) ЗДгІЪБМфЃЈminЃЉ ЪЕбщ1 b a c d ЪЕбщ2 c a b d  N2O4(g)ФцЯђНјааЃЌЖўбѕЛЏЕЊХЈЖШдіДѓЃЌBЦПЕФбеЩЋБШAЦПЕФбеЩЋЩюЁЃ
N2O4(g)ФцЯђНјааЃЌЖўбѕЛЏЕЊХЈЖШдіДѓЃЌBЦПЕФбеЩЋБШAЦПЕФбеЩЋЩюЁЃ
ПМЕуЃКПМВщЖдЪЕбщЕФЗжЮіЁЂЩшМЦЃЌбѕЛЏЛЙдЗДгІЕФЗжЮіЃЌЕчзгзЊвЦЕФБэЪОЃЌЦНКтЕФвЦЖЏЕФХаЖЯ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЕЅбЁЬт
Ш§ЗњЛЏЕЊЃЈNF3ЃЉЪЧвЛжжаТаЭЕчзгВФСЯЃЌЫќдкГБЪЊЕФПеЦјжагыЫЎеєЦјФмЗЂЩњбѕЛЏЛЙдЗДгІЃЌЦфЗДгІЕФВњЮягаЃК HFЁЂ NO КЭ HNO3ЁЃдђЯТСаЫЕЗЈДэЮѓЕФЪЧЃК( )
| AЃЎЗДгІЙ§ГЬжаЃЌБЛбѕЛЏгыБЛЛЙдЕФдЊЫиЕФЮяжЪЕФСПжЎБШЮЊ1 ЃК2 |
| BЃЎNF3ЪЧвЛжжЮоЩЋЁЂЮоГєЕФЦјЬхЃЌвђДЫNF3дкПеЦјжааЙТЉЪБВЛвзБЛВьОѕ |
| CЃЎвЛЕЉNF3аЙТЉЃЌПЩвдгУNaOHШмвКХчСмЕФЗНЗЈМѕЩйПеЦјЮлШО |
| DЃЎШєЗДгІжаЩњГЩ1.0mol NOЃЌзЊвЦЕФЕчзгЪ§ФПЮЊ6.02ЁС1023 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
ЃЈ12 ЗжЃЉЃЈдДДЃЉВПЗжШѕЫсЕФЕчРыЦНКтГЃЪ§ШчБэЃК
| ШѕЫс | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| ЕчРыЦНКтГЃЪ§ ЃЈ25ЁцЃЉ | K=1.8ЁС10Љ4 | K=5.1ЁС10Љ4 | K1=9.1ЁС10Љ8 K2=1.1ЁС10Љ12 | K1=1.23ЁС10Љ2 K2=6.6ЁС10Љ8 | K1=5.4ЁС10Љ2 K2=5.4ЁС10Љ5 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
ЬњФмдкЯЁЯѕЫсжаШмНтЃК ЁњFe(NO3)3ЃЋNOЁќЃЋ2H2O
ЁњFe(NO3)3ЃЋNOЁќЃЋ2H2O
24.дкЩЯЪіЗНГЬЪНЩЯБъГіЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЁЃ
25.ИУЗДгІжаБЛЛЙдЕФдЊЫиЪЧ ЃЌЛЙдМСЪЧ ЁЃ
26.Шєга0.1 molЬњВЮМгЗДгІЃЌБЛЛЙдЕФHNO3ЮЊ molЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
ЃЈ14ЗжЃЉФГОМУПЊЗЂЧјНЋюбвБСЖГЇгыТШМюГЇЁЂМзДМГЇзщГЩСЫвЛИіВњвЕСДЃЈШчЭМЫљЪОЃЉЃЌДѓДѓЕиЬсИпСЫзЪдДРћгУТЪЃЌМѕЩйСЫЛЗОГЮлШОЁЃ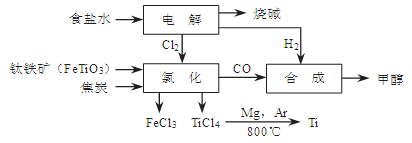
ЧыЬюаДЯТСаПеАзЃК
ЃЈ1ЃЉаДГіюбЬњПѓОТШЛЏЕУЕНЫФТШЛЏюбЕФЛЏбЇЗНГЬЪНЃК ЁЃ
ЃЈ2ЃЉгЩCOКЭH2КЯГЩМзДМЪЧЗХШШЕФЃЌЗНГЬЪНЪЧЃКCO(g)ЃЋ2H2(g)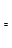 CH3OH(g)ЁЃ
CH3OH(g)ЁЃ
ЂйвбжЊИУЗДгІдк300ЁцЪБЕФЛЏбЇЦНКтГЃЪ§ЮЊ0.27ЃЌИУЮТЖШЯТНЋ2 mol COЁЂ3 mol H2КЭ2 mol CH3OHГфШыШнЛ§ЮЊ2 LЕФУмБеШнЦїжаЃЌДЫЪБЗДгІНЋ ЃЈЬюЁАЯђе§ЗДгІЗНЯђНјааЁБЁЂЁАЯђФцЗДгІЗНЯђНјааЁБЛђЁАДІгкЦНКтзДЬЌЁБЃЉЁЃ
ЂкЯТЭМБэЪОКЯГЩМзДМЗДгІДяЕНЦНКтКѓЃЌУПДЮжЛИФБфЮТЖШЁЂбЙЧПЁЂДпЛЏМСжаЕФФГвЛЬѕМўЃЌЗДгІЫйТЪІдгыЪБМфtЕФЙиЯЕЁЃЦфжаБэЪОЦНКтЛьКЯЮяжаЕФМзДМЕФКЌСПзюИпЕФвЛЖЮЪБМфЪЧ ЁЃЭМжаt3ЪБИФБфЕФЬѕМўПЩФмЪЧ ЁЃ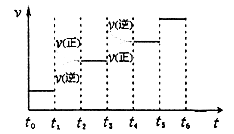
ЃЈ3ЃЉФГЭЌбЇЩшМЦСЫвЛИіМзДМШМСЯЕчГиЃЌВЂгУИУЕчГиЕчНт200mLЁЊЖЈХЈЖШNaClгыCuSO4ЛьКЯШмвКЃЌЦфзАжУШчЭМЃК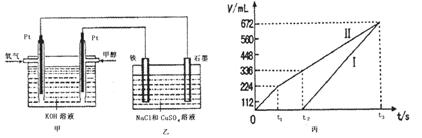
ЂйаДГіМзжаЭЈШыМзДМетвЛМЋЕФЕчМЋЗДгІЪН ЁЃ
ЂкРэТлЩЯввжаСНМЋЫљЕУЦјЬхЕФЬхЛ§ЫцЪБМфБфЛЏЕФЙиЯЕШчБћЭМЫљЪОЃЈЦјЬхЬхЛ§вбЛЛЫуГЩБъзМзДПіЯТЕФЬхЛ§ЃЉЃЌаДГідкt1Кѓ,ЪЏФЋЕчМЋЩЯЕФЕчМЋЗДгІЪН ЃЌдЛьКЯШмвКжаNaClЕФЮяжЪЕФСПХЈЖШЮЊ mol/LЁЃЃЈМйЩшШмвКЬхЛ§ВЛБфЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
ЕЊдЊЫиЙуЗКДцдкгкздШЛНчжа,ЖдШЫРрЩњУќКЭЩњЛюОпгаживЊвтвхЁЃКЌЕЊдЊЫиЕФЛЏКЯЮядкЙЄвЕЩњВњКЭЙњЗРНЈЩшжаЖМгаЙуЗКЕФгІгУЁЃ
ЃЈ1ЃЉЕЊдЊЫидзгКЫЭтга ИіЮДГЩЖдЕчзгЃЌзюЭтВуга жжФмСПВЛЭЌЕФЕчзгЁЃPH3ЗжзгЕФПеМфЙЙаЭЮЊ ЃЌЪЧ ЗжзгЁЃЃЈЬюМЋадЛђЗЧМЋадЃЉ
ЃЈ2ЃЉЕЊКЭСзЪЧЭЌжїзхдЊЫиЃЌЯТСаФмЫЕУїЖўепЗЧН№ЪєадЯрЖдЧПШѕЕФЪЧ ЃЈЬюБрКХЃЉ
aЃЎNH3БШPH3ЮШЖЈадЧП
bЃЎЯѕЫсЯдЧПбѕЛЏадЃЌСзЫсВЛЯдЧПбѕЛЏад
cЃЎЕЊЦјгыЧтЦјФмжБНгЛЏКЯЃЌСзгыЧтЦјКмФбжБНгЛЏКЯ
dЃЎЕЊЦјГЃЮТЪЧЦјЬхЃЌСзЕЅжЪЪЧЙЬЬх
бЧЯѕЫсбЮЪЧЪГЦЗЬэМгМСжаМБадЖОадНЯЧПЕФЮяжЪжЎвЛЃЌПЩЪЙе§ГЃЕФбЊКьЕААзБфГЩе§ЬњбЊКьЕААзЖјЪЇШЅаЏДјбѕЕФЙІФмЃЌЕМжТзщжЏШБбѕЁЃ
ЃЈ3ЃЉбЧЯѕЫсФЦШмвКЕЮМгЕНK2Cr2O7ЫсадШмвКжаЃЌШмвКгЩГШЩЋБфЮЊТЬЩЋЃЌЗДгІШчЯТЃЌВЙЩЯШБЯюЮяжЪВЂХфЦНЃК
Cr2O72Ѓ+ NO2Ѓ+ Ёњ Cr3+ + NO3Ѓ+
ЃЈ4ЃЉЩЯЬтЗДгІжаУПЯћКФ0.6mol NO2ЃЃЌзЊвЦЕчзгЪ§ЮЊ ЁЃ
ЃЈ5ЃЉЕЊбѕЛЏЮяЃЈNOКЭNO2ЃЉЮлШОЛЗОГЁЃШєгУNa2CO3ШмвКЮќЪеNO2ПЩЩњГЩCO2ЃЌ9.2gNO2КЭNa2CO3ШмвКЭъШЋЗДгІЪБзЊвЦЕчзг0.1 molЃЌдђЗДгІЕФРызгЗНГЬЪНЮЊ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
ЯђЪЂгаKIШмвКЕФЪдЙмжаМгШыЩйаэCCl4КѓЕЮМгТШЫЎЃЌCCl4ВуБфГЩзЯЩЋЁЃШчЙћМЬајЯђЪдЙмжаЕЮМгТШЫЎЃЌеёЕДЃЌCCl4ВуЛсж№НЅБфЧГЃЌзюКѓБфГЩЮоЩЋЁЃЭъГЩЯТСаЬюПеЃК
(1)аДГіВЂХфЦНCCl4ВугЩзЯЩЋБфГЩЮоЩЋЕФЛЏбЇЗДгІЗНГЬЪН ЁЃ
(2)ећИіЙ§ГЬжаЕФЛЙдМСЪЧ ЁЃ
(3)АбKIЛЛГЩKBrЃЌдђCCl4ВуБфЮЊ ЩЋЃЛМЬајЕЮМгТШЫЎЃЌCCl4ВуЕФбеЩЋУЛгаБфЛЏЁЃCl2ЁЂHIO3ЁЂHBrO3бѕЛЏадгЩЧПЕНШѕЕФЫГађЪЧ ЁЃ
(4)МгЕтбЮжаКЌЕтСПЮЊ20ЁЋ50 mgЁЄkgЃ1ЁЃжЦШЁМгЕтбЮ(КЌKIO3ЕФЪГбЮ)1 000 kgЃЌШєгУKIгыCl2ЗДгІжЦKIO3ЃЌжСЩйашвЊЯћКФCl2 L(БъзМзДПіЃЌБЃСє2ЮЛаЁЪ§)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
алЛЦ(As4S4)КЭДЦЛЦ(As2S3)ЪЧЬсШЁЩщЕФжївЊПѓЮядСЯЃЌЖўепдкздШЛНчжаЙВЩњЁЃИљОнЬтвтЭъГЩЯТСаЬюПеЃК
(1)As2S3КЭSnCl2дкбЮЫсжаЗДгІзЊЛЏЮЊAs4S4КЭSnCl4ВЂЗХГіH2SЦјЬхЁЃШєAs2S3КЭSnCl2е§КУЭъШЋЗДгІЃЌAs2S3КЭSnCl2ЕФЮяжЪЕФСПжЎБШЮЊ ЁЃ
(2)ЩЯЪіЗДгІжаЕФбѕЛЏМСЪЧ ЃЌЗДгІВњЩњЕФЦјЬхПЩгУ ЮќЪеЁЃ
(3)As2S3КЭHNO3гаШчЯТЗДгІЃК
As2S3ЃЋ10HЃЋЃЋ10NO3Ѓ=2H3AsO4ЃЋ3SЃЋ10NO2ЁќЃЋ2H2OШєЩњГЩ2 mol H3 AsO4ЃЌдђЗДгІжазЊвЦЕчзгЕФЮяжЪЕФСПЮЊ ЁЃШєНЋИУЗДгІЩшМЦГЩвЛдЕчГиЃЌдђNO2гІИУдк (ЬюЁАе§МЋЁБЛђЁАИКМЋЁБ)ИННќвнГіЁЃ
(4)ШєЗДгІВњЮяNO2КЭ11.2 L O2(БъзМзДПі)ЛьКЯКѓгУЫЎЮќЪеШЋВПзЊЛЏГЩХЈHNO3ЃЌШЛКѓгыЙ§СПЕФЬМЗДгІЃЌЫљВњЩњЕФCO2ЕФСП (бЁЬюБрКХ)ЁЃ
aЃЎаЁгк0.5 mol bЃЎЕШгк0.5 mol
cЃЎДѓгк0.5 mol dЃЎЮоЗЈШЗЖЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКЬюПеЬт
гЩЛЦЭПѓ(жївЊГЩЗжЪЧCuFeS2)СЖжЦОЋЭЕФЙЄвеСїГЬЪОвтЭМШчЯТЃК
ЃЈ1ЃЉдкЗДЩфТЏжаЃЌАбЭОЋПѓЩАКЭЪЏгЂЩАЛьКЯМгШШЕН1000ЁцзѓгвЃЌЛЦЭПѓгыПеЦјЗДгІЩњГЩCuКЭFeЕФЕЭМлСђЛЏЮяЃЌСНжжЕЭМлСђЛЏЮяЕФЛЏбЇЪНЗжБ№ЮЊ________ЁЂ_______ЁЃдкЗДгІЙ§ГЬжаЛЙгавЛВПЗжFeЕФСђЛЏЮязЊЛЏЮЊЕЭМлбѕЛЏЮяЃЌЦфЛЏбЇЗДгІЗНГЬЪНЮЊ____________ЁЃ
ЃЈ2ЃЉБљЭ(Cu2SКЭFeSЛЅЯрШлКЯЖјГЩ)КЌCuСПНЯЕЭЁЃзЊТЏжаЃЌНЋБљЭМгШлМС(ЪЏгЂЩА)дк1200ЁцзѓгвДЕШыПеЦјНјааДЕСЖЁЃБљЭжаЕФCu2SБЛбѕЛЏГЩCu2OЃЌЃЌУПга1molбѕЦјВЮМгЗДгІЃЌЩњГЩбѕЛЏВњЮяЕФЮяжЪЕФСПЮЊ_________ЁЃЩњГЩЕФCu2OгыCu2SЗДгІЃЌПЩжЦЕУКЌCuСПНЯИпЕФДжЭЁЃ
ЃЈ3ЃЉДжЭЕФЕчНтОЋСЖШчЭМЫљЪОЁЃдкДжЭЕФЕчНтЙ§ГЬжаЃЌcЮЊДжЭАхЃЌ дђaЖЫгІСЌНгЕчдДЕФ_____МЋ(ЬюЁАе§ЁБЛђЁАИКЁБ)ЃЌШєДжЭжаКЌгаAuЁЂAgЁЂFeдгжЪЃЌдђЕчНтЙ§ГЬжаcЕчМЋЩЯЗЂЩњЗДгІЕФЗНГЬЪНга__________ЁЃ
ЃЈ4ЃЉПЩвдгІгУЫсадИпУЬЫсМиШмвКЕЮЖЈЗЈВтЖЈЗДгІКѓЕчНтвКжаЬњдЊЫиЕФКЌСПЁЃЕЮЖЈЪБВЛФмгУМюЪНЕЮЖЈЙмЪЂЗХЫсадИпУЬЫсМиШмвКЕФдвђЪЧ____________ЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_____________ЃЌЕЮЖЈЪБЃЌзЖаЮЦПжаЕФШмвКЛсНгДЅПеЦјЃЌВтЕУЬњдЊЫиЕФКЌСПЛс____(ЬюЁАЦЋИпЁБЛђЁАЦЋЕЭЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com