
【题目】工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是
A. 10 min内,T1时v(CH4)T2时小 B. 温度:T1<T2
C. ΔH:a < 0 D. 平衡常数:K(T1)<K(T2)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/L的CH3COOH 溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
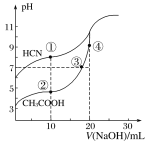
A. 室温下,电离平衡常数:K(HCN)>K(CH3COOH)
B. 点①和点②所示溶液中:c(CH3COO-)>c(CN-)
C. 点③所示的溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D. 点④所示的溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素 A、B、C、D、E 的最高价氧化物对应的水化物分别为 X、Y、M、Z、W,B 是短周期主族元素中原子半径最大的元素,常温下 X、Y、Z、W 均可与 M 反应,A、B、D、E 的原子序数及其对应 0.1mol/L X、Y、Z 、W 溶液的 pH 如图所示。
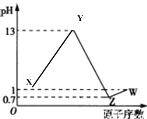
下列说法正确的是:
A. D的简单气态氢化物的热稳定性大于E的气态氢化物热稳定性
B. A、B、C 三种元素简单离子半径的大小顺序为C>B>A
C. Y 的稀溶液与 Z 或 W 的稀溶液分别发生中和反应时,对应的中和热在数值上相等
D. Y与W 两物质的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关油脂的叙述不正确的是( )
A.天然油脂是混合物,没有固定的熔点和沸点
B.油脂是酯的一种
C.油脂是由高级脂肪酸和甘油所生成的酯
D.油脂都不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1000mol/L的NaOH溶液分别滴加到20.00mL浓度均为0.1000mol/L的一元酸HX和HY溶液中,溶液的pH与所加NaOH体积的关系如图所示,下列叙述错误的是
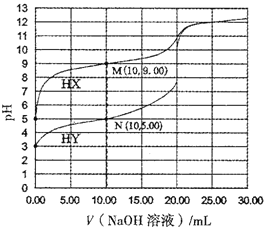
A. N点溶液中c(Y-)>c(Na+)>c(OH-)>c(H+)
B. 常温下,0.1000mol/LHY溶液的电离度约为1%
C. Ka(HX)数量级为10-9
D. 用NaOH溶液滴定HY可用酚酞做指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是
2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
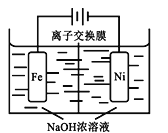
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知马尔氏盐晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,不溶于乙醇,受热易分解,是分析化学中的重要试剂。回答下列问题:
(1)马尔氏盐晶体的制备:
甲组同学利用新生成的硫酸亚铁溶液与硫酸铵溶液反应制备马尔氏盐晶体(已知所使用的铁屑中含有少量的Fe2O3和FeS杂质),装置如图所示;

①为了使A中所制得的FeSO4中不含Fe3+,应使______________________过量(填化学式)。
②实验前期,需要用生成的H2将装置中的空气排尽,其原因是______________________,装置B中的试剂为____________(填写试剂名称)。
③装置A中反应一段时间后,若不拆卸装置,如何使装置A中生成的FeSO4进入装置C中,叙述操作过程____________________________________________。
(2)验证马尔氏盐晶体分解的气态产物成分:
提出假设:马尔氏盐晶体分解可能生成H2O、NH3、SO3、___________等气态化合物。
实验验证:实验小组取一定量马尔氏盐晶体隔绝空气加强热分解,利用下列裝置检验气态产物的成分(防倒吸装置已略去),试完成下表:
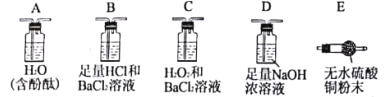
操作步骤 | 实验现象 | 结论 |
①按___→___→____顺序连接装置(填字母)。 | ②______________________ ______________________。 | 证明气体产物中含有H2O和NH3。 |
③按B→C→D顺序连接装置,其中装置B的作用是______________________。 | B中无明显现象,C中有白色沉淀生成。 | ④_____________________ ______________________。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com