
| a |
| x |
| 0.7 |
| 3 |
| 0.7mol-3amol |
| 2 |
| a |
| x |
| 0.7mol-3amol |
| 2 |
| a |
| x |
| 2.1x |
| x+2 |
| 0.7 |
| 3 |
| 2.1x |
| x+2 |
| 0.7 |
| 3 |
| 2.1x |
| x+2 |
| 2.1x |
| x+2 |
| 0.7mol-3n(Al3+) |
| 2 |
| 0.7mol-3×0.1mol |
| 2 |
| 0.1mol |
| 0.1mol+0.2mol+0.7mol |
0.7mol-
| ||
| 2 |
| 0.7-2.8x |
| 2+x |
0.7mol-
| ||
| 2 |
| 0.7-2.8x |
| 2+x |
| 0.7-2.8x |
| 2+x |
| 6.4x+0.2 |
| 2+x |
| 2.1x |
| x+2 |
| 2.1x |
| x+2 |
| 6.4x+0.2 |
| 2+x |
| 2x-0.2 |
| 2+x |
| 2x-0.2 |
| 2+x |
| 0.7-2.8x |
| 2+x |
| 0.5-0.8x |
| 2+x |
| 0.7-2.8x |
| 2+x |
| 0.5-0.8x |
| 2+x |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
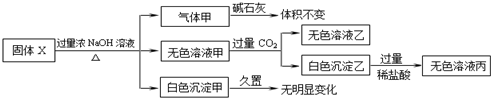
| A、气体甲一定是纯净物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4、MgCl2 |
| D、固体X中一定不存在FeCl2、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色试液加入氯化钡溶液有白色沉淀,结论:试液中含有SO42- |
| B、无色溶液加入硝酸银溶液有白色沉淀,结论:试液中含有Cl- |
| C、无色试液加入Na2CO3溶液产生白色沉淀,结论:试液中含Ca2+ |
| D、某气体能使湿润的红色石蕊试纸变蓝,结论:该气体为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
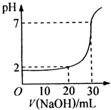 如图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示.依据图示,推出盐酸和NaOH的物质的量浓度是( )
如图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示.依据图示,推出盐酸和NaOH的物质的量浓度是( )| 物质的量浓度(mol/L) | A | B | C | D |
| c(HCl) | 0.12 | 0.04 | 0.03 | 0.09 |
| c(NaOH) | 0.04 | 0.12 | 0.09 | 0.03 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、常温下,醋酸和ROH溶液的pH之和为14时,等体积混合,所得溶液呈碱性 |
| B、在x点时,ROH完全电离 |
| C、在x点,c(M+)>c(R+) |
| D、稀释前,c(ROH)=10c(MOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油兼有酯类和烯烃的性质 |
| B、油的熔点高,脂肪的熔点低 |
| C、天然油脂都是单甘油酯 |
| D、羧酸与醇生成的酯就是油脂,沾有油脂的试管可使用纯碱溶液洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com