
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2、N2O4的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
科目:高中化学 来源:2015-2016学年吉林省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.在化学键的断裂过程中,肯定发生了化学反应
B.发生能量变化的一定是化学反应
C.离子化合物中一定含有离子键,共价化合物中一定不含离子键
D.在化学键的断裂过程中,肯定放出能量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:选择题
已知七种短周期元素a~g的有关信息如下表所示:
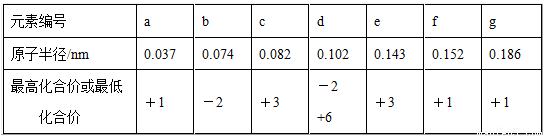
下列推断不正确的是( )
A.氢化物稳定性的强弱:b>d
B.元素e的氧化物只能与酸反应
C.金属性的强弱:f<g
D.元素a与元素d形成的化合物属于共价化合物
查看答案和解析>>
科目:高中化学 来源:2016届青海省高三下高考冲刺一理综化学试卷(解析版) 题型:选择题
用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是
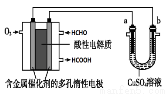
A.当a、b都是铜做电极时,电解的总反应方程式为:2CuSO4+2H2O  2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
B.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
C.当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mole-
D.燃料电池工作时,负极反应为:HCHO+ H2O-2e-=HCOOH + 2H+
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三模拟考试二理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质]原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为________。
(4)Z与R能形成化合物甲,1mol甲中含________mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为________,________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为______ __。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为 __。
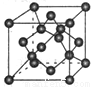
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;若X晶体的密度为p g·cm-3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为________cm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三模拟考试二理综化学试卷(解析版) 题型:选择题
四种短周期元素X、Y、Z、W,已知X、Y的阳离子aXn+、bY(n+1)+电子层结构与Z、W的阴离子cZm-、dW(m+1)-电子层结构相同。下列叙述正确的是
A.最高价氧化物对应水化物的碱性大小顺序一定是:X>Y
B.离子半径和原子半径由大到小的顺序均为X>Y>Z>W
C.氢化物的稳定性是Z>W;氢化物的沸点是Z<W
D.还原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川一中高三三模理综化学试卷(解析版) 题型:填空题
一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
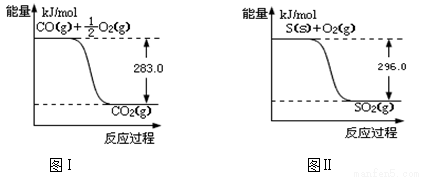
回答下列问题:
(1)SO2(g) + 2CO(g)  S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NO及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系如图所示。
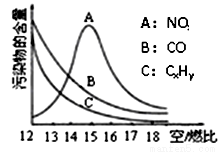
已知:N2与O2生成NO的反应是吸热反应。请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是 。
②当空/燃比达到15后,NO减少的原因可能是 。
(4)一定条件下H2与CO合成CH3OH,CH3OH再转化成为CH3OCH3,转化的热化学反应方程式如下:2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
在250℃、压强不变的密闭容器中,加入2mol的CH3OH,一段时间后上述反应达平衡,体系放出热量11 kJ;若同一条件下加入0.2mol CH3OCH3和0.2mol H2O,一段时间后上述反应达平衡,体系的热效应为 .
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:选择题
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:
① 取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
② 在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据对上述实验的分析判断,最后得出的结论合理的是( )
A.不能判断溶液中是否存在SO42- B.溶液中一定不存在的离子是CO32-
C.不能判断溶液中是否存在Ag+ D.不能判断是否含有 AlO 离子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下列关于化学反应限度的说法中正确的是( )
A.改变外界条件不能改变化学反应限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com