
����Ŀ��һ�ָ�������Fe3S4��þ�Ķ��ε�أ��乤��ԭ��Ϊ��Fe3S4+4Mg![]() 3Fe+4MgS��װ����ͼ��ʾ������˵������ȷ����
3Fe+4MgS��װ����ͼ��ʾ������˵������ȷ����
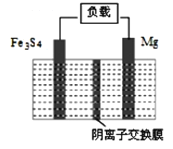
A. �ŵ�ʱ����·��ת��0.5mol�����������ӽ���Ĥ���ƶ�0.5molS2��
B. �ŵ�ʱ�������ĵ缫��ӦʽΪFe3S4+8e����3Fe+4S2��
C. ���ʱ�������ĵ缫��ӦʽΪMgS+2e����Mg+S2��
D. ���ʱ��S2���������ӽ���Ĥ������Ҳ�Ǩ��
���𰸡�AD
��������
���ݵ�ط�Ӧʽ֪���ŵ�ʱΪԭ��ط�Ӧ��Mgʧ���ӷ���������Ӧ����Mg�Ǹ������缫��ӦʽΪMg-2e-=Mg2+��Fe3S4Ϊ������������ӦʽΪFe3S4+8 e-=3Fe+4S2-��
A��ͨ�����Ϸ���֪,�ŵ�ʱ,�����غ�͵���غ��������·��ת��0.5mol�����������ӽ���Ĥ���ƶ�0.25mol S2-����A����
B���ŵ�ʱ��Fe3S4Ϊ������������ӦʽΪFe3S4+8 e-=3Fe+4S2-������Bѡ������ȷ����
C�����ʱ��ԭ��صĸ������Դ�ĸ���������������ԭ��Ӧ�������ĵ缫��ӦʽΪMgS+2e����Mg+S2��������Cѡ������ȷ����
D��ԭ��صĸ������Դ�ĸ���������ԭ��ص��������Դ�����������������Ϊ�������Ҳ�Ϊ���������ʱ��S2��Ӧ�����������������ӽ���Ĥ�Ҳ������Ǩ������D������
��������������ӦѡAD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը����Ϊԭ�ϣ��绯ѧ���Ʊ��ظ���ص�ʵ��װ��ʾ��ͼ���£�����˵������ȷ����( )

A. �������ң������ĵ缫��ӦΪ2H2O��2e��=2OH����H2��
B. �������ң�ͨ�����Һ���ɻ�ɫ��Ϊ��ɫ������Ϊ������H��Ũ������ʹƽ��2CrO��2H��![]() Cr2O��H2O�����ƶ�
Cr2O��H2O�����ƶ�
C. ���Ʊ��������ܷ�Ӧ�Ļ�ѧ����ʽΪ4K2CrO4��4H2O=2K2Cr2O7��4KOH��2H2����O2��
D. �ⶨ����Һ��K��Cr�ĺ�������K��Cr�����ʵ���֮��(nK/nCr)Ϊd�����ʱ����ص�ת����Ϊ1��d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӏ�������ֵ������˵����ȷ����( )
A. 1molNa2O2�����к���������Ϊ4 NA
B. ������ΪNA��CO��C2H4����������ԼΪ22.4L������Ϊ28g
C. 28g��C2H4��C3H6��ɵĻ�����к�����ԭ�ӵ���ĿΪ4NA
D. �����£�1mol Fe�����ŨHNO3��Ӧ��ת�Ƶ��ӵ���ĿΪ3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��A�Ļ�ѧʽΪC4H9Cl����֪A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻��A�Ļ�ѧ����Ϊ________��
��2��ͬʱ�������������ı���ͬ���칹��Ľṹ��ʽ��________��
�ٺ���3��˫��
�ں˴Ź�������ֻ��ʾ1�����շ�
�۲����ڼ�
��3��д��ͬʱ��������������C6H10O4������ͬ���칹��Ľṹ��ʽ_________________��
��ֻ��һ�ֹ����ţ�����״�ṹ���ޡ�O��O�����ۺ˴Ź�������ֻ��2�ַ塣
��4��ij�������ǽṹʽΪ![]() ��ͬ���칹�壬�ҷ�����ֻ�����ֲ�ͬ��ѧ�������⡣д���û�����Ľṹ��ʽ��________(��дһ��)��
��ͬ���칹�壬�ҷ�����ֻ�����ֲ�ͬ��ѧ�������⡣д���û�����Ľṹ��ʽ��________(��дһ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������C��H��O���л���3.24 gװ��Ԫ�ط���װ�ã�ͨ��������O2ʹ֮��ȫȼ�գ������ɵ���������ͨ��CaCl2��(A)�ͼ�ʯ��(B)�����A������������2.16 g��B��������9.24 g����֪���л������Է�������Ϊ108��
(1)ȼ�մ��л���3.24 g������O2����g��
(2)����л���ķ���ʽ��
(3)���л���1��������1����������д������ͬ���칹��Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ܱ������м���2mol A��0.6mol C��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯�������ͼ����ʾ��ͼ��Ϊt2ʱ�̺�ı䷴Ӧ��������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ����������֪t3��t4��Ϊʹ�ô�����ͼ����t0��t1��c��B��δ������
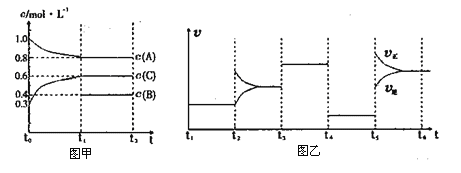
����˵������ȷ����
A. �÷�ӦΪ���ȷ�Ӧ
B. B��t0~t1�ε�ת����Ϊ60%
C. t4~t5�θı������Ϊ��Сѹǿ
D. ���¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.84
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��Q��M�����ֶ�����Ԫ�أ�ԭ��������������X��ԭ�Ӱ뾶��С��Ԫ�أ�Y����̬�⻯����ʹʪ��ĺ�ɫʯ����ֽ������ZΪ�ؿ��к�������Ԫ�أ�R��Xͬ���壻Y��R��Q����������֮��Ϊ8��M�ĵ���Ϊ����ɫ�к����塣��ش��������⣺
��1��R��Ԫ�����ڱ��е�λ��Ϊ__________________��
��2��Z��Q��M�����Ӱ뾶�ɴ�С��˳��Ϊ(дԪ�����ӷ���)_______________��
��3��X��Y��Z����Ԫ���γ���������ˮ��Һ�����Ե�ԭ��________________(�����ӷ���ʽ��ʾ)����Һ����������Ũ���ɴ�С��˳��Ϊ______________��
��4��YX4M�ĵ���ʽΪ______________��Q3Y2��ˮ�ɾ��ҷ�Ӧ���������������壬��Ӧ�Ļ�ѧ����ʽΪ_________________________________��
��5��M�ĵ�����R������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��KClO3��Ũ������һ���¶��·�Ӧ����ԭ����Ϊ����ɫ���ױ���������ȡ���仯���Ա�ʾΪ����KClO3+��HCl��Ũ������KCl+��ClO2��+��Cl2��+��H2O+��__________
(1)����ƽ�û�ѧ����ʽ_____________________________________��
(2)Ũ�����ڷ�Ӧ����ʾ������������______________________________(����)��
��ֻ�л�ԭ�Ԣڻ�ԭ�Ժ����Ԣ�ֻ�������Ԣ������Ժ�����
����֪��Ӧ��2H2CrO4+3H2O2=2Cr(OH)3��+2H2O�÷�Ӧ��H2O2ֻ�������±仯����H2O2��H2O
(1)�÷�Ӧ�еĻ�ԭ����__________________________��
(2)�÷�Ӧ�б���ԭ��Ԫ����_______________����ԭ������_____________________��
(3)�������������ڱ�״�������Ϊ3.36L����Ӧ��ת����_________mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ҹ��������������������2.5�����µ�ϸ������(PM2.5)�ǵ�������������������������������е�CO��SO2�������������Ⱦ�����ͨ��������ѧ��Ӧ����PM2.5�����
��1�� ��CaSO4����O2��ȼ��CO��Ӧ����һ�ָ�Ч����ࡢ���õ�����ȼ�ռ������ȿ����ȼ��Ч�ʣ����ܵõ��ϴ���CO2���Ա��ڱ���������Ӧ��Ϊ����Ӧ����Ӧ�ں͢�Ϊ����Ӧ��
����CaSO4(s)��4CO(g)==CaS(s)��4CO2(g) ��H1����189.2 kJ��mol-1
����CaSO4(s)��CO(g)==CaO(s)��CO2(g)��SO2(g)�� ��H2����210.5 kJ��mol-1
����CO(g)==![]() C(s)��
C(s)��![]() CO2(g) ��H3����86.2 kJ��mol-1
CO2(g) ��H3����86.2 kJ��mol-1
��Ӧ2CaSO4(s)��7CO(g)==CaS(s)��CaO(s)��6CO2(g)��C(s)��SO2(g)����H��_________________
��2����֪��CO����CO2�Ļ�ѧ����ʽΪCO��O2![]() CO2��O��������Ӧ����Ϊv��=K����c(CO) ��c(O2)���淴Ӧ����Ϊv��=K����c(CO2) ��c(O)��K����K��Ϊ���ʳ�������2500 K����K��=1.21��105 L��s-1��mol-1��K��=3.02��105 L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ________(����С�����һλС��)��
CO2��O��������Ӧ����Ϊv��=K����c(CO) ��c(O2)���淴Ӧ����Ϊv��=K����c(CO2) ��c(O)��K����K��Ϊ���ʳ�������2500 K����K��=1.21��105 L��s-1��mol-1��K��=3.02��105 L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ________(����С�����һλС��)��
��3���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������Ӧ��C(s)��2NO(g)![]() N2(g)��CO2(g)����H=Q kJ��mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)��CO2(g)����H=Q kJ��mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��(min) Ũ��(mol��L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��0��10 min�ڣ�NO��ƽ����Ӧ����v(NO)=___________________________________��
��30 min��ֻ�ı�ijһ��������Ӧ����ƽ�⣬�����ϱ������жϸı������������____(ѡ����ĸ)��
a������һ�����Ļ���̿ b��ͨ��һ������NO c���ʵ���С��������� d��������ʵĴ���
����30min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ5��3��3����Q_____0 (������������������������)��
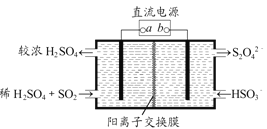
��4��������ͼ��ʾ���װ��(�缫��Ϊ���Ե缫)Ҳ������SO2�������������ų�����Һ����NO2�����Դb�����ӵĵ缫�ĵ缫��ӦʽΪ____________________________________��
��5��NO2��һ�������¿�ת��ΪNH4NO3��NH4NO2����ͬ�¶�������Ũ��NH4NO3��NH4NO2������Һ�����NH4NO2��Һ��c(NH4+)��С���������ܵ�ԭ��________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com