
| A. | 加压 | B. | 加入NaCl溶液 | C. | 加AgNO3溶液 | D. | 加盐酸 |
分析 使溶液变成淡蓝色,采取的操作使溶液中[Cu(H2O)4]2+浓度增大,即使平衡向逆反应方向移动,根据勒夏特列原理,只有通过减小Cl-浓度才能达到这种移动,据此分析.
解答 解:使溶液变成淡蓝色,采取的操作使溶液中[Cu(H2O)4]2+浓度增大,即使平衡向逆反应方向移动,根据勒夏特列原理,只有通过减小Cl-浓度才能达到这种移动.
A、该反应在溶液中进行,所以加压平衡不移动,故A错误;
B、加入NaCl溶液,即增大氯离子浓度,平衡向右移动,故B错误;
C、加入AgNO3溶液,银离子和氯离子结合生成氯化银沉淀,溶液中Cl-浓度浓度减小,平衡逆向进行,使黄绿色氯化铜溶液向蓝色转化,故C正确;
D、加入食盐晶体,溶液中Cl-浓度浓度增大,平衡向右移动,故D错误.
故选C.
点评 本题考查平衡的移动,难度中等,可以借助平衡常数理解稀释对平衡的影响.


科目:高中化学 来源: 题型:解答题
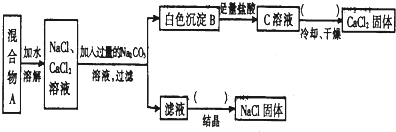
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的摩尔质量是71 g/mol | |
| B. | 通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐 | |
| C. | 酸性的雨水都是酸雨,酸雨的PH小于7 | |
| D. | 1mol CO2的质量是44 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭除去冰箱中的异味 | B. | 燃烧液化石油气为炒菜提供热量 | ||
| C. | 食物长时间放置后变质腐败 | D. | 烧菜用过的铁锅出现红棕色斑迹 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、OH-、SO42- | B. | Fe3+、NO3-、Na+、OH- | ||
| C. | H+、Na+、Cl-、SO42- | D. | K+、SO42-、HCO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | A→C的反应为吸热反应 | B. | 三种物质中B最不稳定 | ||
| C. | 加入催化剂,E1、E2、E3、E4均不变 | D. | A→C反应的△H=E1-E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:
在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com