
 ,故答案为:
,故答案为: ;
;| 44.8×10-3L |
| 22.4L/mol |
| 2 |
| 10 |
| 1 |
| 2 |


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
| A、将金属锂保存在石蜡中 |
| B、少量的白磷可保存在水中 |
| C、碱溶液用带磨口玻璃瓶塞的试剂瓶保存 |
| D、硝酸银溶液盛放在棕色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、Al3+、CO32-、Cl- |
| B、Cu2+、NO3-、H+、Cl- |
| C、Na+、OH-、SO42-、HCO3- |
| D、K+、NO3-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
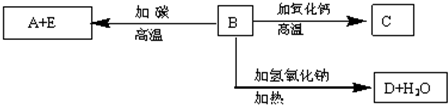
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com