
| A、c(Na+)=c(CH3COO-) |
| B、原NaOH溶液的浓度为0.5 mol/L |
| C、原溶液中c(CH3COO-)>c(OH-) |
| D、原NaOH溶液的浓度小于0.5 mol/L |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、504mL |
| B、336mL |
| C、224mL |
| D、168mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质熔点:W>Z |
| B、离子半径:W>X>Z |
| C、最高正价:W>X>Z |
| D、原子序数:Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时俯视刻度线 |
| B、没有洗涤烧杯和玻璃棒 |
| C、用托盘天平称量0.6gNaCl固体 |
| D、配制前容量瓶中残留少量的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛浓盐酸的分液漏斗可用长颈漏斗代替 |
| B、为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验 |
| C、可用饱和食盐水吸收尾气 |
| D、可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
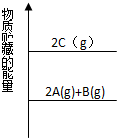
| A、C(g)=A(g)+1/2B(g)△H<0 |
| B、2C=2A+B△H>0 |
| C、2A+B=2C△H>O |
| D、A(g)+1/2B(g)=C(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2s22p2和2s22p4 |
| B、3s1和3s23p4 |
| C、3s23p4和2s22p4 |
| D、3s2和2s22p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用加入适量铁粉的方法除去Cu(NO3)2溶液中混有的AgNO3 |
| B、用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 |
| C、向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- |
| D、用加热的方法提纯含有少量碳酸氢钠的碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com