
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)×c6(H2O) |
| c4(NH3)×c5(O2) |
| ||
| 2min |
| 2×2.5mol-0.25×2.5mol |
| 5L |


科目:高中化学 来源:不详 题型:多选题
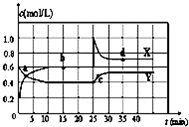
| A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线 |
| B.前10min内用v(N2O4)表示的化学反应速率为0.2mol/(L?min) |
| C.25min时,NO2转变为N2O4的反应速率增大,其原因是将密闭容器的体积缩小为1L |
| D.前10min内用v(NO2)表示的化学反应速率为0.04mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 一定条件 |
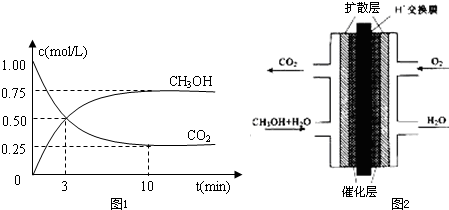
| n(CH3OH) |
| n(CO2) |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol3mol0mol |
| B.0mol0mol2mol |
| C.0.5mol1mol1mol |
| D.1mol3mol2mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水应密闭保存,放置于低温处 |
| B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质 |
| C.生产硝酸的过程中使用过量空气以提高氨气的利用率 |
| D.实验室常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C.若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol |
| D.保持其它条件不变,升高温度,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com