
| A. | ②⑥ | B. | ②⑤ | C. | ①③④ | D. | ②⑤⑥ |
分析 可逆反应达到平衡状态时,正逆反应速率相等且不等于0,反应体系中各物质的物质的量、物质的量浓度、百分含量都不变,以及由此引起的一系列物理量不变,据此分析解答.
解答 解:①C的生成速率与C的分解速率相等时,正逆反应速率相等,反应达到平衡状态,故正确;
②无论反应是否达到平衡状态都存在单位时间内生成a molA、同时生成3a molB,所以不能据此判断平衡状态,故错误;
③该反应达到平衡状态时,正逆反应速率相等,反应体系中A、B、C的浓度不再变化,所以可以据此判断平衡状态,故正确;
④该反应是一个反应前后气体体积减小的可逆反应,当混合气体总压强不变时,该反应达到平衡状态,所以可以据此判断平衡状态,故正确;
⑤该反应是一个反应前后气体体积减小的可逆反应,当混合气体总物质的量不变时,该反应达到平衡状态,所以可以据此判断平衡状态,故正确;
⑥A、B、C、D的分子数之比为1:3:2:2时,该反应不一定达到平衡状态,与反应初始物质的量及转化率有关,所以不能据此判断平衡状态,故错误;
故选A.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量不变时该反应达到平衡状态,注意该反应特点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol•L-1的溶液 | |
| B. | 用硫粉覆盖地下撒有的汞;用热碱溶液洗去试管内壁的硫;用二氧化碳扑灭金属钠引起的失火;用湿润的红色石蕊试纸检验氨气是否集满;以上操作均合理 | |
| C. | 用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 | |
| D. | SO2溶于水,其水溶液能导电,说明SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,M的化学式为FeS,F的电子式为
,M的化学式为FeS,F的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
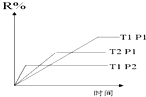
| A. | 正反应吸热,L是气体 | B. | 正反应吸热,L是固体 | ||
| C. | 正反应放热,L是气体 | D. | 正反应放热,L是固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com