
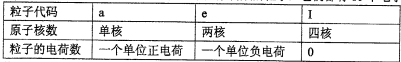
①A、B两种离子在加热条件下作用可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
请回答下列问题:
(1)微粒A的化学式是____________;微粒E的名称是____________。构成微粒F的元素周期表中的位置是________________________。
(2)写出下列反应的离子方程式:
F+过量C溶液:________________________________________________,W+含大量B离子的溶液:________________________________________________。
(3)六种微粒中的两种可与硫酸根形成一种复盐,向该复盐的浓溶液中逐滴加入苛性钠溶液,产生的现象有:a.溶液中出现白色沉淀;b.沉淀逐渐增多;c.有刺激性气味气体放出;d.沉淀逐渐减少;e.沉淀完全消失。
则该复盐在溶液中的电离方程式是________________________。
(1)![]() 水合氢离子 第三周期ⅢA族
水合氢离子 第三周期ⅢA族
(2)Al3++3NH3·H2O====Al(OH)3↓+![]()
Al(OH)3+OH-====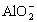 +2H2O
+2H2O
(3)NH4Al(SO4)2====![]() +Al3++2
+Al3++2![]()
解析:由②知C为NH3,由非金属元素组成且含有10个电子的阳离子只有两种:![]() 和H3O+。由①知A为
和H3O+。由①知A为![]() ,B为OH-,D为H2O。由③知E为H3O+。向白色沉淀W中加含大量B(OH-)离子或大量E(H3O+)离子的溶液,W都会溶解,说明W为Al(OH)3,F为Al3+。向复盐溶液中加入NaOH溶液,产生刺激性气味的气体,则有
,B为OH-,D为H2O。由③知E为H3O+。向白色沉淀W中加含大量B(OH-)离子或大量E(H3O+)离子的溶液,W都会溶解,说明W为Al(OH)3,F为Al3+。向复盐溶液中加入NaOH溶液,产生刺激性气味的气体,则有![]() ;随NaOH溶液逐滴加入,先出现白色沉淀,随后增多,到沉淀逐渐减少到最后完全消失,则含有Al3+,因而该复盐为NH4Al(SO4)2。
;随NaOH溶液逐滴加入,先出现白色沉淀,随后增多,到沉淀逐渐减少到最后完全消失,则含有Al3+,因而该复盐为NH4Al(SO4)2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解


| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
①A、B两种离子在加热条件下作用可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
请回答下列问题:
(1)微粒A的化学式是______________;微粒E的名称是______________。构成微粒F的元素在周期表中的位置是______________。
(2)写出下列反应的离子方程式:
F+过量C溶液:________________________________________________________;
W+含大量B离子的溶液:_________________________________________________。
(3)六种微粒中的两种可与硫酸根形成一种复盐,向该复盐的浓溶液中逐滴加入苛性钠溶液,产生的现象有:a.溶液中出现白色沉淀,b.沉淀逐渐增多,c.有刺激性气味气体放出,d.沉淀逐渐减少,e.沉淀完全消失。
则该复盐在溶液中的电离方程式是___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com