
【化学——选修3:物质结构与性质】(15分)
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________;X基态原子的电子排布图是
Z所在周期中第一电离能最大的主族元素是________(写出元素名称)。R原子结构示意图为 。
(2)XY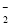 的立体构型是________;R2+的水合离子中,
的立体构型是________;R2+的水合离子中,
提供孤电子对的原子是________(写出元素符号)。
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是________。

(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________________________________。
37.物质结构 每空2分
(1)1s22s22p4  氯
氯 
(2)①V形 ②O
(3)2∶1
(4)2Cu+8NH3·H2O+O2===2[Cu(NH3)4]2++4OH-+6H2O(1分)
【解析】
试题分析::X、Y、Z、R为前四周期元素,且原子序数依次增大,XY2是红棕色气体,应是NO2,则X为N元素、Y为O元素;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等,则M层电子数为2,故Z为Mg;R2+离子的3d轨道中有9个电子,R原子核外电子数=2+8+8+9+2=29,则R为Cu元素,(1)Y为O元素,基态原子的电子排布式是1s22s22p4,Z为Mg元素,所在周期中第一电离能最大的主族元素是Cl元素,答案为:1s22s22p4;Cl;(2)NO2-离子中心N原子孤电子对=[5+1-2x2]:2=1,价层电子对数=2+1=3,故NO2-离子的立体构型是V形;Cu2+的水合离子中,提供孤电子对的原子是H2O中O原子,答案为:V形;O;(3)晶胞中阳离子处于体心与顶点,晶胞中阳离子数目=1+8×1/8=2,阴离子处于处于体内及面上,晶胞中阴离子数目=2+4×1/2=4,故晶胞中阴离子与阳离子的个数比是4:2=2:1,答案为:2:1;(4)将Cu单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,说明得到四氨合铜络离子,还应生成氢氧根离子与水,该反应的离子方程式是2Cu+8NH3?H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O。
考点:考查核外电子排布、电离能、分子结构、配合物、晶胞等知识。


科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3-
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
2Al3++3SO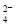 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算(解析版) 题型:选择题
已知热化学方程式:SO2(g)+O2(g)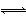 SO3(g) ΔH=-98.32 kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量( )
SO3(g) ΔH=-98.32 kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量( )
A.=196.64 kJB.=98.32 kJ C.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)  pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
A.②③④⑥ B.③⑥⑦ C.②③⑥ D.③⑥
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
下列有关热化学方程式的评价合理的是( )
| 实验事实 | 热化学方程式 | 评价 |
A | 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合 | H2SO4(aq)+Ba(OH)2(aq) =BaSO4(s)+ 2H2O(l) △H=-114.6 kJ·mol-1 | 正确 |
B | 醋酸与稀氢氧化钠溶液混合 | CH3COOH(aq)+NaOH(aq) =CH3COONa(aq)+H2O(l) △H=-57.3kJ·mol-1 | 不正确;因为醋酸状态为“aq”,而不是“l”。 |
C | 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ | SO3(g)+H2O(l)=H2SO4(aq) △H=-130.3 kJ·mol-1 | 不正确;因为反应热为△H=-260.6kJ·mol-1 |
D | 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ | C(s)+O2(g)=CO2(g) △H=-393.51 kJ·mol-1 | 不正确;同素异形体要注名称:C(石墨) |
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期第一次月考理综试卷(解析版) 题型:选择题
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且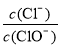 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后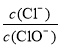 =11,则溶液中
=11,则溶液中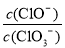 =
=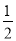
B.参加反应的氯气的物质的量等于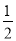 a mol
a mol
C.改变温度,产物中KClO的最大理论产量为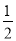 a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为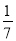 a mol
a mol
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三入学考试化学试卷(解析版) 题型:填空题
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物。已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1;18.0 g水蒸气液化时的能量变化为44.0 kJ。
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式 。
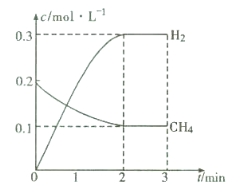
(2)在一定条件下,向体积固定为2 L的密闭容器中充人0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图所示。3 min时改变条件,反应进行到4 min时,体系中各物质的物质的量如下表所示:
t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mo1 |
4 | 0.18 | 0.38 | 0.22 | 0.66 |
则3~4min之间,平衡向 (填“正”或“逆”)反应方向移动,3min时改变的条件是 。
(3)已知温度、压强和碳水比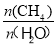 对该反应的影响如图所示。
对该反应的影响如图所示。
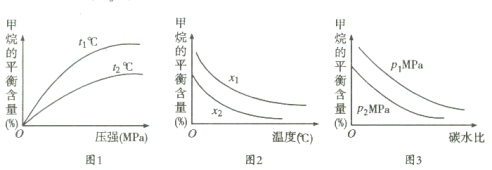
①图1中,两条曲线所示温度的关系:t1 t2(填“>”、“<”或“=”,下同)
②图2中,两条曲线所示碳水比的关系:x1 x2
③图3中,两条曲线所示压强的关系:p1 p2
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
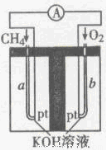
①放电时,正极的电极反应式为
②假设装置中盛装100.0 mL 3.0mol·L-1KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为 。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:选择题
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为
A.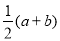 molB.
molB.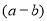 molC.
molC.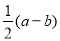 molD.
molD. 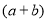 mol
mol
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市2012级临诊考试化学试卷(解析版) 题型:选择题
金属M和N可构成如图所示的装置.下列分析正确的是
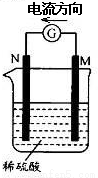
A.金属活泼性N>M
B.M逐渐溶解
C.负极反应为2H++2e- =H2↑
D.SO42-向M极定向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com