
| A. | 臭氧空洞的形成主要与SO2有关 | |
| B. | 酸雨的形成主要与SO2有关 | |
| C. | 光化学烟雾的形成主要与NO2等有关 | |
| D. | 水体富营养化的形成主要与含氮、磷污水的排放有关 |
分析 A.臭氧空洞是大气中的氟利昂等物质造成的;
B.酸雨的形成是因为煤燃烧,生成二氧化硫等气体与雨水反应的结果;
C.光化学烟雾,是城市大气中的碳氢化合物(HC)和氮氧化合物(NOx)在阳光紫外线的作用下发生的一系列链式大气化学反应生成以臭氧(O3)为代表的刺激性二次污染物;
D.水体富营养化是氮磷含量过高引起的.
解答 解:A.臭氧空洞是大气中的氟利昂等物质造成的,与SO2无关,故A错误;
B.酸雨的形成是因为煤燃烧,生成二氧化硫等气体与雨水反应的结果,与SO2有关,故B正确;
C.光化学烟雾,是城市大气中的碳氢化合物(HC)和氮氧化合物(NOx)在阳光紫外线的作用下发生的一系列链式大气化学反应生成以臭氧(O3)为代表的刺激性二次污染物,与NO2等有关,故C正确;
D.水体富营养化是氮磷含量过高引起的,与含氮、磷污水的排放有关,故D正确.
故选BCD.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y的氢化物比同族氢化物的沸点均高 | |
| B. | X、Y、Z形成的化合物不止一种 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量氢氧化钠固体 | |
| B. | 将溶解的氢氧化钠溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| C. | 定容时,俯视刻度线 | |
| D. | 定容后倒转容量瓶几次摇匀溶液,发现凹液面最低点低于刻度线,再补几滴水到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 热稳定性:正丁烷>异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g)△H=-1560.8kJ•mol-1 | |
| C. | 正戊烷的燃烧热大约在3540kJ•mol-1左右 | |
| D. | 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应的水化物化学式为H2YO3 | |
| B. | 元素Y和W的非金属性强弱比较:Y<W | |
| C. | 原子半径由小到大的顺序为:Y<X<W<Z | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
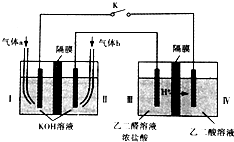 乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | 电极Ⅱ上的电极反应式:O2+4e-+2H2O═4OH- | |
| B. | 电极Ⅳ上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O | |
| C. | 乙二醛与Ⅲ电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=2HCl+HOOC-CHO | |
| D. | 若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com