
| A. | 洪灾区民众用明矾净水并用漂白粉消毒,二者化学原理相同 | |
| B. | 燃煤发电厂在煤燃烧时加入一些生石灰,能减少废气中的二氧化硫排放 | |
| C. | 洗涤脱排油烟机表面的油脂污物时,热的纯碱溶液比冷的去污效果好 | |
| D. | 通讯领域中的光导纤维不可长期浸泡在强碱性溶液中 |
分析 A.根据明矾、漂白粉的净水原理分析.
B.加入少量的石灰石,二氧化硫可转化为硫酸钙;
C.依据盐类水解应用及影响盐类水解因素解答;
D.光导纤维主要成分为二氧化硅,二氧化硅能够与氢氧化钠等强碱反应而被腐蚀造成断路.
解答 解:A.根据明矾的净水原理:铝离子能水解生成胶体,胶体具有吸附性,能吸附水中的悬浮物而用来净水;漂白粉的净水原理:消毒漂白粉中的次氯酸钙[Ca(ClO)2]与水和空气中的CO2反应生成了次氯酸(HClO)和另一种物质,次氯酸具有杀菌消毒作用而净水,两者的净水原理不相同,故A错误;
B.加入少量的石灰石,二氧化硫可转化为硫酸钙,可减少二氧化硫的污染,故B正确;
C.温度升高,有利于碳酸根的水解平衡正向移动,生成的氢氧根浓度越大,碱性越强,酯的水解越彻底,去油污效果好,故C正确;
D.光导纤维主要成分为二氧化硅,二氧化硅能够与氢氧化钠等强碱反应而造成断路,所以通讯领域中的光导纤维不可长期浸泡在强碱性溶液中,故D正确;
故选:A.
点评 本题为综合题,涉及环境污染与治理、饮用水的净化处理、盐类水解的应用,明确相关物质的性质及盐类水解影响因素是解题关键,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解熔融Al2O3制金属铝,用铁作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 | |
| D. | 在镀件上镀锌,用锌用阳极,硫酸锌作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
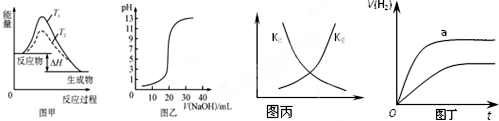
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则aHCl表示溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
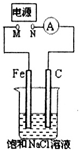
| A. | M连接电源正极,N连接电源负极,当两极产生气体总量为22.4mL(标准状况)时,则生成0.001molNaOH | |
| B. | 去掉电源,将M、N用导线直接相连,在溶液中滴入酚酞试液,C电极周围溶液变红 | |
| C. | M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1LCuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 | |
| D. | M连接电源正极,N连接电源负极,将C电极换成Cu电极,电解质溶液换成硫酸铜溶液,则可实现在铁上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有强氧化性,故可作漂白剂 | |
| B. | 可通过加热氯化铵固体使其分解的办法来制备氨气 | |
| C. | 浓硝酸中的HNO3见光会分解,故要盛放在棕色试剂瓶中 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中的Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
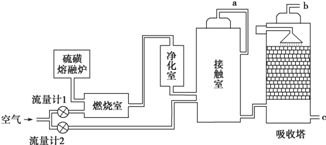
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com