
【题目】(Ⅰ)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液 B、升华 C、降温结晶 D、分液 E、蒸馏 F、过滤
①____分离饱和食盐水与沙子的混合物;
②____从硝酸钾和氯化钠的混合液中获得硝酸钾;
③____分离水和汽油的混合物;
④____分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃);
⑤____分离出混在沙土中的碘单质。
(Ⅱ)掌握仪器名称、组装及使用方法是中学化学实验的基础。如图为实验室制取蒸馏水的实验装置。

(1)写出下列仪器的名称:a.___;b___
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是____,将仪器补充完整后进行实验,温度计水银球的位置在___处。冷凝水由___(填f或g)口通入___(填f或g)流出。
(3)实验时a中除加入少量自来水外,还需加入少量___,其作用是_____。
【答案】F C D E B 蒸馏烧瓶 冷凝管(冷凝器) 酒精灯 蒸馏烧瓶支管口处 g f 沸石 防止暴沸
【解析】
(Ⅰ)结合各物质的性质,结合常见物质分离操作的方法进行分析;
(Ⅱ)(1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶、酒精灯,根据仪器的结构特点判断;
(2)实质是蒸馏过程须用酒精灯加热,冷凝管中冷却水的进出采用“逆流”原理;
(3)给液体加热,加入沸石,以防液体暴沸。
(Ⅰ)①沙子不溶于水,NaCl溶于水,则分离方法为过滤法;
故答案是:F;
②硝酸钾和氯化钠都溶于水,但二者在水中的溶解度不同,硝酸钾溶解度随温度变化较大,而氯化钠溶解度随温度变化不大,可用结晶的方法分离;
故答案是:C;
③水和汽油不互溶,混合静置后分层,可用分液的方法分离;
故答案是:D;
④CCl4和甲苯混溶,但二者沸点不同,相差较大,可用蒸馏的方法分离;
故答案是:E;
⑤碘加热易升华,而沙土较稳定,可用升华的方法分离;
故答案是:B。
(Ⅱ)(1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶、酒精灯;所以a为蒸馏烧瓶,b为冷凝管;
故答案是:蒸馏烧瓶;冷凝管;
(2)分离四氯化碳和酒精的混合物用蒸馏的方法分离,必须用酒精灯,温度计应位于蒸馏烧瓶支管口处;为达到较好的冷却效果,冷凝管下口是进水口,上口是出水口;
故答案是:酒精灯;蒸馏烧瓶支管口处;g;f;
(3)给液体加热时要加入少量的沸石(或碎瓷片),防止液体在加热过程中剧烈沸腾,发生危险;
答案是:沸石;防止暴沸。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某化学学习小组进行如下实验:
Ⅰ.探究反应速率的影响因素 设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L - 1 H2C2O4溶液、0.010 mol·L -1KMnO4 溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽

(1)若上述实验②、③是探究浓度对化学反应速率的影响,则 a 为______________;乙是实验需要测量的物理量,则表格中“乙”应 填写__________________。
Ⅱ.测定 H2C2O4·xH2O 中 x 值 已知:M(H2C2O4)=90 g·mol-1 ① 称取 1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液; ② 取 25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4; ③ 用浓度为 0.05 000 mol·L -1 的 KMnO4 标准溶液进行滴定。
反应原理为:5 H2C2O4 + 2 MnO4— + 6H+ = 10CO2↑+ 2Mn2+ + 8H2O
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是________(选填 a、b)。由图可知消耗 KMnO4 溶液体积为________ mL。

(3)滴定终点锥形瓶内现象为__________________________________________________。
(4)通过上述数据,求得 x=______________。
(5)下列操作会造成所测x偏大的是____________(填字母)。
A.滴定终点俯视读数
B.锥形瓶用待测溶液润洗
C.滴定前有气泡,滴定后没有气泡
D.配制100mL待测溶液时,有少量溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了一个“黑笔写红字”的趣味实验滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
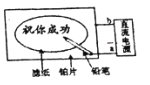
A.铅笔端作阳极,生成氢气B.铂片端作阴极,生成氯气
C.铅笔端有少量的氯气产生D.a点是负极,b点是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32- )、c(HCO3)都减少,其方法是
A. .加入氢氧化钠固体 B. 加氯化钠固体 C. 通入二氧化碳气体 D. 加入氢氧化钡固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的名称正确的是( )
A. 1,2—二甲基丁烷B. 2-乙基-1-丁烯
C. 2,3,3—三甲基丁烷D. 2,3—二甲基-4-乙基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨与水性质相似,也存在微弱的电离:2NH3![]() NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
A. 液氨的电离平衡 B. 液氨的离子积常数
C. c(NH4+) D. c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏伽德罗常数可表示为NA,则下列说法正确的是
A. 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子
B. 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA
C. 常温常压下,22.4LH2O中含有的氢原子数为2NA
D. 标准状况下,0.3molCO2中含有氧原子数0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
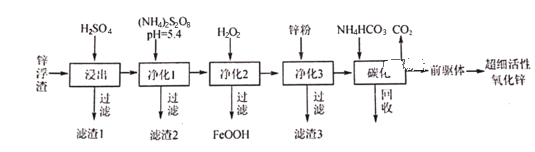
(1)滤渣1的成分为___________。
(2)在S2O82-的结构式中只含有一根“O一O”非极性键,则S的化合价为___________;工业上常用惰性电极电解(NH4)2SO4生产(NH4)2S2O8(过二硫酸铵),阳极电极反应式为__________________。净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:______________________。
(3)净化3的目的_________________________________。
(4)碳化回收溶液的主要成分为___________,该物质循环使用的目的___________________。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com