
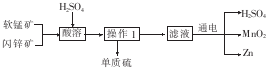
| A. | 酸溶时,ZnS作氧化剂 | B. | 硫酸可以循环使用 | ||
| C. | 可用盐酸代替硫酸进行酸溶 | D. | MnO2和ZnS均属于盐 |
分析 软锰矿和闪锌矿加入硫酸,发生氧化还原反应可生成硫、硫酸锌和硫酸锰,过滤得到硫,滤液中含有硫酸锰、硫酸锌和硫酸,电解,得到锌、二氧化锰和硫酸,以此解答该题.
解答 解:A.软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)在酸溶后生成了硫单质,说明二氧化锰做氧化剂,ZnS为还原剂,故A错误;
B.酸溶后在最后电解滤液时又生成,可以循环利用,故B正确;
C.盐酸代替硫酸进行酸溶,盐酸溶液中氯离子被氧化生成氯气,且影响锰离子的电解,故C错误;
D.MnO2属于氧化物,故D错误.
故选B.
点评 本题考查工业流程的分析判断,为高频考点,侧重于学生的分析能力和实验能力的考查,题目涉及电解原理的应用,注意把握物质的性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 22.4ac/bNA | B. | 22.4ab/cNA | C. | 22.4bc/aNA | D. | 22.4b/acNA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ④⑤⑥ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题:
在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | 植物通过光合作用将二氧化碳转化为葡萄糖是太阳能转化为热能的过程 | |
| C. | 在101kPa时,1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热 | |
| D. | 热化学方程式中的△H的值与反应物的用量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脚气病 | B. | 坏血病 | C. | 夜盲症 | D. | 神经炎 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com