
 A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题:
A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题: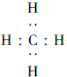 ,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.
,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.分析 A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,B原子的L层P轨道中有2个电子,其原子核外电子排布为1s22s22p2,则B为碳元素;E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态,则E原子核外电子数=2+8+18+1=29,故E为Cu元素;D与B原子的价电子数相同,结合原子序数可知D为Si,C的原子核外有三个未成对电子,原子序数小于Si,则其外围电子排布为2s22p3,故C为N元素;五元素核电荷数之和为57,故A的核电荷数=57-6-7-14-29=1,故A为H元素,
(1)B,D原子可分别与A原子形成只含一个中心原子的共价化合物X和Y,X为CH4、Y为SiH4;
(2)原子晶体的熔点大于分子晶体;
(3)同周期随原子序数增大元素第一电离能呈增大趋势,且N元素2p能级为半满稳定状态;Cu的原子核外有29个电子,其阳离子含有27 个电子;
(4)Cu2+NH3形成的配离子为[Cu(NH3)4]2+;
(5)由图可知,晶胞为面心立方堆积,以顶点的原子分析;先求出晶胞的质量和体积,再根据$ρ=\frac{m}{V}$计算.
解答 解:A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,其原子核外电子排布为1s22s22p2,则B为碳元素;E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态,则E原子核外电子数=2+8+18+1=29,故E为Cu元素;D与B原子的价电子数相同,结合原子序数可知D为Si,C的原子核外有三个未成对电子,原子序数小于Si,则其外围电子排布为2s22p3,故C为N元素,五元素核电荷数之和为57,故A的核电荷数=57-6-7-14-29=1,故A为H元素,
(1)C、Si可分别与H元素形成只含一个中心原子的共价化合物X和Y,则X为CH4、Y为SiH4,
CH4分子中C原子与H原子之间形成1对共用电子对,其电子式为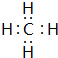 ;SiH4中Si原子呈4个σ键、不含孤电子对,故Si原子采取sp3杂化;N与H形成的常见化合物为NH3,分子构型为三角锥形,
;SiH4中Si原子呈4个σ键、不含孤电子对,故Si原子采取sp3杂化;N与H形成的常见化合物为NH3,分子构型为三角锥形,
故答案为: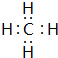 ;sp3;三角锥形;
;sp3;三角锥形;
(2)B和D的最高价氧化物分别为CO2、SiO2,由于SiO2是原子晶体而CO2是分子晶体,故熔点较高,
故答案为:SiO2;SiO2是原子晶体而CO2是分子晶体;
(3)同周期随原子序数增大元素第一电离能呈增大趋势,且N元素2p能级为半满稳定状态,故N元素第一电离能高于碳元素;Cu2+的核外电子排布式为1s22s22p63s23p63d9,
故答案为:N;1s22s22p63s23p63d9;
(4)Cu2+与C的常见氢化物NH3形成的配离子的离子反应方程式为Cu2++4NH3═[Cu(NH3)4]2+,
故答案为:Cu2++4NH3═[Cu(NH3)4]2+;
(5)由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻最近,1个顶点原子为12个面共用,故配位数为12;
Cu原子半径为d,由图丙可知,正方形对角线长度为4d,立方体的棱长为$\frac{\sqrt{2}}{2}$×4d=2$\sqrt{2}$d,晶胞体积为(2$\sqrt{2}$d )3=16$\sqrt{2}$d3 ,晶胞中含有原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Al相对原子质量为M,故晶胞的质量=$4×\frac{M}{{N}_{A}}$g,故晶体的密度=$\frac{4×\frac{M}{{N}_{A}}}{16\sqrt{2}{d}^{3}}$=$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$;
故答案为:$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$.
点评 本题考查物质结构与性质,涉及元素周期律、分子结构、杂化轨道、核外电子排布、晶体类型与性质、晶胞结构与计算等,注意对电离能突变的理解,晶胞计算需要学生具有一定的数学计算能力与空间想象力,难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | HC≡CH | C. | CH2=C(CH3)2 | D. | HC≡C-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | 饮食“镉大米”会影响骨骼和肾脏,镉元素属于重金属元素 | |
| C. | 使用增塑剂--邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴阳离子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 环境污染 |  白色污染 |  雾霾 |  臭氧空洞 |  酸雨 |
| 产生原因 | 聚乙烯等塑料 | 胶体的丁达尔效应 | 氟利昂的泄漏 | 煤的直接燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |||||||||
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,则CH4的燃烧热△H=-890.3 kJ | |||||||||
| C. | H2(g)+Br2(g)═2HBr(g)△H=-72 kJ•mol-1其他相关数据如表:
| |||||||||
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁丝在氯气中燃烧:Fe+Cl2$\frac{\underline{\;点燃\;}}{\;}$FeCl2 | |
| B. | 常温下,0.1mol/L醋酸溶液pH≈3 CH3COOH?CH3COO-+H+ | |
| C. | 铝片放入氢氧化钠溶液中有气体产生 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | 蔗糖与浓硫酸混合产生刺激性气味的气体 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
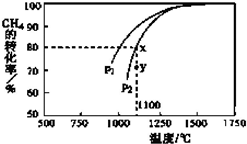 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com