
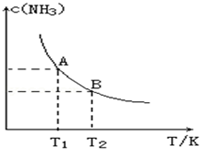
 ��һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
��һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%������ ����ͼ1��֪���¶�Խ�ߣ�ƽ��ʱNH3��Ũ��ԽС��˵�������¶�ƽ�����淴Ӧ���У�ƽ�ⳣ����С��
����μӷ�Ӧ�ĵ��������ʵ���Ϊnmol����������ʽ��n��ʾ����ƽ��ʱ����ֵ����ʵ��������ݰ�������������з��̼���n��ֵ����N2�Ļ�ѧ��Ӧ���ʣ�
��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1��
��� �⣺����ͼ��֪���¶�Խ�ߣ�ƽ��ʱNH3��Ũ��ԽС��˵�������¶�ƽ�����淴Ӧ���У�ƽ�ⳣ����С����ƽ�ⳣ��KA��KB���¶�Խ�ߣ�KֵԽС����������Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ����������
����μӷ�Ӧ�ĵ��������ʵ���Ϊnmol����
N2��g��+3H2��g��?2NH3��g��
��ʼ��mol����1 3 0
�仯��mol����n 3n 2n
ƽ�⣨mol����1-n 3-3n 2n
��������$\frac{2n}{��1-n��mol+��3-3n��mol+2nmol}$��100%=25%�����n=0.4�����ʱ����N2�Ļ�ѧ��Ӧ����Ϊ$\frac{\frac{0.4mol}{10L}}{5.00min}$=8.00��10-3mol/��L•min����
�ʴ�Ϊ��8.00��10-3mol/��L•min����
��K1=$\frac{��\frac{2��0.4mol}{10L}��^{2}}{\frac{��1-0.4��mol}{10L}����\frac{3mol-3��0.4mol}{10L}��^{3}}$=18.3L2/mol2
�ʴ�Ϊ��18.3L2/mol2��
���� ���⿼�黯ѧƽ����㡢��Ӧ���ʼ��㡢ƽ�ⳣ�����㼰Ӧ�ã��Ѷ��еȣ�ע����������ƽ�ⳣ����Ӧ�ã�


 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2��������HCl���壨����������Һ�� | B�� | CO�л���CO2��ʯ��ˮ��Ũ���ᣩ | ||
| C�� | CO2��������CO����������ͭ�� | D�� | Cl2�л���HCl������ʳ��ˮ��Ũ���ᣩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 һ������CO2��������C�ں����ܱ������з�����Ӧ��C��s��+CO2��g��?2CO��g����H��
һ������CO2��������C�ں����ܱ������з�����Ӧ��C��s��+CO2��g��?2CO��g����H���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H+��aq��+OH-��aq��=H2O��l����H=-a kJ/mol����1 mol NaOH������������ϡ���ᷴӦ���ų�����Ϊa kJ | |
| B�� | ��CuSO4•5H2O��s��=CuSO4��s��+5H2O��1����H=+b kJ/mol����1 mol CuSO4�� s����������ˮʱ���ų�����Ϊb kJ | |
| C�� | ��������ȼ����Ϊc kJ/mol���ʵ��ˮ���Ȼ�ѧ����ʽΪ��2H2O��1��=2H2�� g��+O2�� g����H=+c kJ/mol | |
| D�� | ��N2�� g��+3H2�� g��?2NH3�� g����H=-d kJ/mol������ij������Ͷ��1 mol N2��3 mol H2 ��ַ�Ӧ�ų�����С��d kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״���CO2��ֱ�Ӻϳ�DMC��2CH3OH��g��+CO2 ��g��?CH3OCOOCH3 ��g��+H2O��g�������״�ת����ͨ�����ᳬ��1%����Լ�÷�Ӧ����ҵ��������
�״���CO2��ֱ�Ӻϳ�DMC��2CH3OH��g��+CO2 ��g��?CH3OCOOCH3 ��g��+H2O��g�������״�ת����ͨ�����ᳬ��1%����Լ�÷�Ӧ����ҵ���������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ﵽ��ѧƽ��ʱ������ȫת��ΪNH3 | |
| B�� | �ﵽ��ѧƽ��ʱ��N2��H2��NH3�����ʵ���Ũ��һ����� | |
| C�� | �ﵽ��ѧƽ��ʱ��N2��H2��NH3�����ʵ���Ũ�Ȳ��ٱ仯 | |
| D�� | �ﵽ��ѧƽ��ʱ������Ӧ���ʺ��淴Ӧ���ʶ�Ϊ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
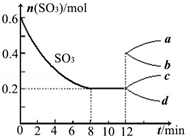 ��һ��2L���ܱ�������Ͷ�뷴Ӧ�������Ӧ2SO3��g��?2SO2��g��+O2��g����H��0������SO3�ı仯��ͼ��ʾ��
��һ��2L���ܱ�������Ͷ�뷴Ӧ�������Ӧ2SO3��g��?2SO2��g��+O2��g����H��0������SO3�ı仯��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCI+NaOH�TNaCl+H2O | |
| B�� | Zn+2HCl�TZnCl2+H2�� | |
| C�� | HCl+AgNO3�TAgCl��+HNO3 | |
| D�� | MnO2+4HCI ��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+C12��+2H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com