
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 氢氧化铝、碳酸氢钠都可用于治疗胃酸过多 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入适量食品添加剂 | |
| D. | 用化纤面料替代棉质面料,以减少二氧化碳的排放 |
分析 A.油脂碱性条件下水解,可生成肥皂;
B.氢氧化铝、碳酸氢钠能与盐酸反应;
C.适量食品添加剂可改善食物的色、香、味并防止变质;
D.化纤面料的制造需要消耗大量能量.
解答 解:A.地沟油的主要成分是油脂,油脂碱性条件下水解成为造化反应,可生成肥皂,故A正确;
B.氢氧化铝、碳酸氢钠能与盐酸反应,可治疗胃酸过多,故B正确;
C.适量食品添加剂在安全范围内使用,可改善食物的色、香、味并防止变质,故C正确;
D.化纤面料的制造需要消耗大量能量,增加二氧化碳的排放,故D错误.
故选D.
点评 本题考查较为综合,涉及化学与生活、生产、食品添加剂等,为高考常见题型和高频考点,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
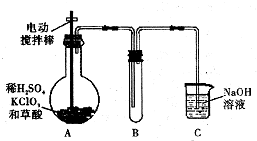 ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.
ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.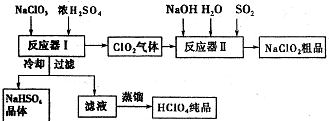
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
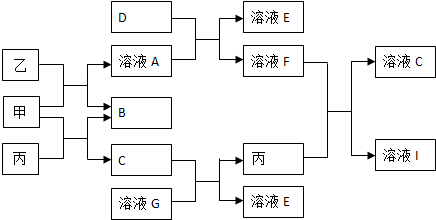
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
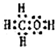 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
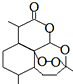 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 步骤① | 取适量NaOH固体放入烧杯中,加入适量的水,搅拌,插入一支温度计 测量溶液温度, | 溶液温度比室 温明显升高 | 氢氧化钠 固体溶于 水放热 |
| 步骤② | 步骤①所得的溶 液冷却到室温,用胶头滴管将稀盐酸滴入到步骤①所得的溶液中 | 溶液温度比室 温明显升高 | 氢氧化钠与稀盐 酸反应会放出热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com