
【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质发生水解反应的离子方程式
(1)Na2CO3溶液中滴加酚酞呈红色,原因是__________(用离子方程式表示),加热后颜色变 ___________________________。
(2)CH3COONa溶液PH___7(填“>”“<”或“=”),原因是__________(用离子方程式表示)。
(3)普通泡沫灭火器内的玻璃筒里﹣盛硫酸铝溶液,铁筒里﹣盛碳酸氢钠溶液,其化学反应的原理是______(用离子方程式表示),不能把硫酸铝溶液盛在铁筒里的原因是(用离子方程式表示)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为 CuFeS2。试回答下列问题:
(1)基态硫原子核外电子有_____种不同运动状态,能量最高的电子所占据的原子轨道形状为_________。
(2)基态Cu原子的价层电子排布式为_________;Cu、Zn的第二电离能大小I2(Cu) _________I2(Zn)(填“>”“<”或“=”)。
(3)SO2分子中S原子的轨道杂化类型为_________,分子空间构型为_________;与SO2互为等电子体的分子有_________(写一种)。
(4)请从结构角度解释H2SO3的酸性比H2SO4酸性弱的原因_________。
(5)Cu(CH3CN)4比四氨合铜离子稳定,其配离子中心原子配位数为_________,配位体中σ键与π键个数之比为_________。
(6)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间距离为anm。则该晶体的密度为_________g/cm3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO![]() 、SiO
、SiO![]() 、SO
、SO![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:
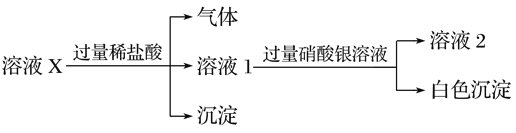
下列说法正确的是( )
A. 溶液X中一定含有Na+、Cl-和SiO![]()
B. 溶液X中一定不含Ca2+、Br-
C. 为确定溶液X中是否含有SO![]() ,可取溶液2,加入BaCl2溶液
,可取溶液2,加入BaCl2溶液
D. 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变成血红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是![]()
![]()
石油![]() 分馏产品
分馏产品![]() 乙烯
乙烯![]() .
.
A. 石油主要是由烃组成的混合物
B. ![]() 主要发生物理变化
主要发生物理变化
C. ![]() 包括裂化、裂解等过程
包括裂化、裂解等过程
D. ![]() 是加成反应,产物名称是二溴乙烷
是加成反应,产物名称是二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容积的容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是
A. SO2为0.4 molL-1,O2为0.2 molL-1 B. SO2为0.25 molL-1
C. SO2、SO3均为0.15 molL-1 D. SO3为0.4 molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com