
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 硅是人类将太阳能转换为电能的常用材料 | |
| D. | 由粗硅制备单晶硅不涉及氧化还原 |
分析 A.水晶主要成分是二氧化硅;
B.盐酸与二氧化硅不反应;
C.硅是良好的半导体材料;
D.有化合价变化的反应属于氧化还原反应.
解答 解:A.水晶主要成分是二氧化硅,二氧化硅是氧化物,不是硅酸盐,故A错误;
B.二氧化硅能够与氢氟酸反应,被氢氟酸腐蚀,所以工艺师利用氢氟酸刻蚀石英制作艺术品,故B错误;
C.硅是良好的半导体材料,是人类将太阳能转换为电能的常用材料,故C正确;
D.粗硅制备单晶硅的反应是,Si+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4,SiCl4+2H2$\frac{\underline{\;\;△\;\;}}{\;}$Si+4HCl,反应中有化合价变化,涉及氧化还原反应,故D错误;
故选:C.
点评 本题主要考查了硅及其化合物的性质和用途,掌握粗硅的提纯是解答本题的关键,注意对硅及其化合物用途的积累,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | A与B的相对分子质量之比为m:n | |
| B. | 同温同压下,两气体A与B的密度之比为n:m | |
| C. | 同质量的A与B分子个数之比为m:n | |
| D. | 相同状况下,同体积的气体A与B 质量比为m:n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
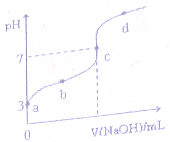 已知常温下CH3COOH的电离平衡常数为 k0,常温下,向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol.L-1NaOH溶液,其 pH变化曲线如图所示(忽略温度变化).下列说法正确的是( )
已知常温下CH3COOH的电离平衡常数为 k0,常温下,向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol.L-1NaOH溶液,其 pH变化曲线如图所示(忽略温度变化).下列说法正确的是( )| A. | a点表溶液中由水电离出的温度为1.0xl0-3mol•L-1 | |
| B. | b 点表示的溶液 c (CH3COO-)<c (Na+) | |
| C. | b、d点表示的溶液中$\frac{c(C{H}_{3}COO)•c({H}^{+})}{c(C{H}_{3}COOH)}$相等 | |
| D. | c点表示CH3COOH和NaOH恰好反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铜片和铁片紧靠在一起浸入稀H2SO4中,铜片表面出现气泡 | |
| B. | 把铁钉和碳棒用铜线连接后,浸入0.1 mol•L-1的食盐溶液中,铁钉作负极被腐蚀 | |
| C. | 把铜片插入氯化铁溶液中,在铜片表面出现一层铁 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 1mol/L | D. | 2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4 | B. | 稀HNO3 | C. | 盐酸 | D. | CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com