
【题目】如图所示,对该物质的说法正确的是

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为6 mol、7 mol
D. 该分子中的所有碳原子可能共平面
【答案】D
【解析】
A.此有机物遇FeCl3溶液显紫色,苯酚的同系物应符合有且只有一个苯环,且苯环上只连一个羟基,其余全部是烷烃基,A错误;
B.能使酸性KMnO4褪色的官能团有酚羟基、碳碳双键、苯环上的甲基等,因此滴入酸性KMnO4溶液,观察紫色褪去,不能证明结构中存在碳碳双键,B错误;
C.与浓溴水反应的应是酚羟基邻对位上的氢被溴取代,左边苯环邻对位上只有一个H,右边苯环邻对位上有两个H,还有一个碳碳双键与溴水发生加成反应,共消耗4 mol的Br2;两个苯环、一个碳碳双键均能与氢气发生加成反应,因此共消耗7 mol的氢气,C错误;
D.从苯环的平面结构及乙烯的平面结构出发,把上述结构分成三部分:右边以苯环为中心8个碳原子共平面,左边以苯环为中心8个碳原子共平面,还有以碳碳双键为中心4个碳原子共平面,上述三个平面可以重合,D正确。
答案选D。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca、Sr、Ba是第IIA族相邻的三种元素,下列关于Sr的推测正确的是
A.Sr是一种金属元素B.Sr是一种良好的半导体材料
C.Sr的硫酸盐易溶于水D.Sr的最高价氧化物对应水化物是一种强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过反应;3Cl2+6KOH![]() 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
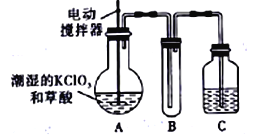
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_______________________________。
(2)请分析装置图,进行补充和完善。A部分缺___________装置,B部分还应补充____________装置,还有一处设计明显不合理的是___________(填“A”“B”或“C”)
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:______________________________________。
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________(不考虑Cl2的挥发)
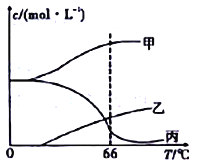
(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 molL-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 molL-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为_________。(已知Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,C1O3-可被Fe2+还原为Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
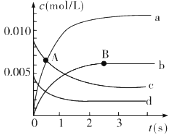
反应过程如图所示,其中只有3条曲线是正确的。请回答:
(1)A点处,v(正)____v(逆) (填“大于”“小于”或“等于”,下同),A点正反应速率_______B点正反应速率。
(2)图中表示NO2的变化的曲线是___。用O2表示从0~2 s内该反应的平均速率v=__。
(3)能说明该反应已经达到平衡状态的是________ (填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.减小O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域应用广泛。下图是利用乙酰丙酸![]() 合成聚芳酯E的路线(省略部分产物):
合成聚芳酯E的路线(省略部分产物):

己知:
(1)A生成B的反应类型为_________,B与D的反应类型为____ 。
(2)A的结构简式为____。
(3)C分子的核磁共振氢谱中有_____ 个吸收峰;同时符合下列要求的C的同分异构体有____种。
①能发生银镜反应 ②能与NaHCO3溶液反应 ③遇FeCl3溶液显紫色
(4)己知尿素![]() 中氮原子上的氢原子,在一定条件下可以像苯酚中苯环上的氢原子那样与甲醛发生加成反应,并可缩聚成线型结构,形成聚醚类脲甲醛树脂。请写出尿素与甲醛按照1:2的配比,发生聚合反应形成线型脲甲醛树脂的化学方程式____。
中氮原子上的氢原子,在一定条件下可以像苯酚中苯环上的氢原子那样与甲醛发生加成反应,并可缩聚成线型结构,形成聚醚类脲甲醛树脂。请写出尿素与甲醛按照1:2的配比,发生聚合反应形成线型脲甲醛树脂的化学方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com