
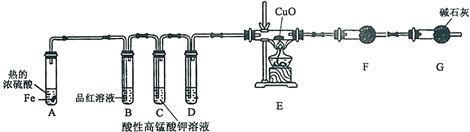
分析 加热条件下,Fe与浓硫酸反应生成二氧化硫,当硫酸浓度减小,变为稀硫酸时,生成氢气,检验二氧化硫用品红溶液,生成的氢气与CuO反应生成水蒸气,通过检验水蒸气的存在,可以证明生成了氢气,所以D装置要干燥氢气,F装置为无水硫酸铜检验水蒸气,G装置是为了防止空气中的水蒸气产生干扰;
(1)根据装置图分析;G装置是为了防止空气中的水蒸气产生干扰;
(2)浓硫酸变为稀硫酸时,与Fe反应生成氢气;
(3)D中药品是用来干燥氢气;无水硫酸铜遇水变蓝色;
(4)在加热条件下,CuO与氢气反应生成Cu;
(5)若A中反应后铁有剩余,则溶液转化Fe为Fe2+,Fe2+在空气中能被氧气氧化为Fe3+;
(6)根据Fe+2H2SO4═SO2↑+FeSO4+H2O,Fe+H2SO4═H2↑+FeSO4计算.
解答 解:加热条件下,Fe与浓硫酸反应生成二氧化硫,当硫酸浓度减小,变为稀硫酸时,生成氢气,检验二氧化硫用品红溶液,生成的氢气与CuO反应生成水蒸气,通过检验水蒸气的存在,可以证明生成了氢气,所以D装置要干燥氢气,F装置为无水硫酸铜检验水蒸气,G装置是为了防止空气中的水蒸气产生干扰;
(1)由装置图可知,仪器G的名称是干燥管;F装置为无水硫酸铜检验水蒸气,G装置干燥管中是干燥剂,可以吸收空气中的水蒸气,防止空气中的水蒸气进入F产生干扰;
故答案为:干燥管;防止空气中的水进入F装置;
(2)浓硫酸变为稀硫酸时,与Fe反应生成氢气,其反应的方程式为:Fe+H2SO4═H2↑+FeSO4;
故答案为:Fe+H2SO4═H2↑+FeSO4;
(3)D中药品是用来干燥氢气,D中药品为液体干燥剂,所以D中为浓硫酸;CuO与氢气反应生成水蒸气,水蒸气进入F中使无水硫酸铜变蓝色;
故答案为:浓硫酸;检验水的生成;
(4)E转化固体为CuO,在加热条件下,CuO与氢气反应生成Cu,所以现象为黑色固体变红;
故答案为:黑色固体变红;
(5)若A中反应后铁有剩余,则溶液转化Fe为Fe2+,Fe2+在空气中能被氧气氧化为Fe3+,所得溶液久置于空气中会生成红褐色絮状物,即生成了氢氧化铁沉淀,所以反应的离子方程式为:12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+;
故答案为:12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+;
(6)测得反应前后E装置的质量减少了0.32g,则n(O)=$\frac{0.32g}{16g/mol}$=0.02mol,则(H2)=0.02mol,由Fe+H2SO4═H2↑+FeSO4,可知消耗硫酸为0.02mol,所以发生Fe+2H2SO4═SO2↑+FeSO4+H2O的硫酸为0.18-0.02=0.16mol,所以FeSO4为0.16mol×$\frac{1}{2}$+0.02mol=0.1mol,所以FeSO4溶液物质的量浓度为10mol/L;
故答案为:10.
点评 本题考查了了浓硫酸的化学性质,题目难度中等,注意掌握Fe与浓硫酸的反应原理及氢气的检验方法,试题侧重基础知识的考查,有利于提高学生灵活应用基础知识的能力.


科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:计算题
现有4g氢氧化钠恰好与100ml的盐酸完全反应,试计算(写计算过程)
(1)氢氧化钠的物质的量
(2)钠离子的数目
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
发射“嫦娥一号”月球探测卫星的长征三号甲运载火箭的第三级使用的燃料是液氢和液氧,已知下列热化学方程式:①H2(g)+1/2O2(g)==H2O(l)ΔH1=-285.8kJ/mol
②H2(g)==H2(l)ΔH2=-0.92kJ/mol,③O2(g)==O2(l)ΔH3=-6.84kJ/mol
④H2O(l)==H2O(g)ΔH4=+44.0kJ/mol则反应H2(l)+1/2O2(l)==H2O(g)的反应热ΔH为
A.+237.46kJ/mol B.-474.92kJ/mol C.-118.73kJ/mol D.-237.46kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
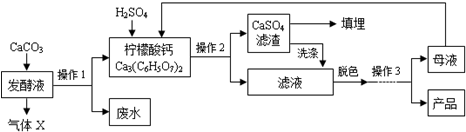
 柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:
柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
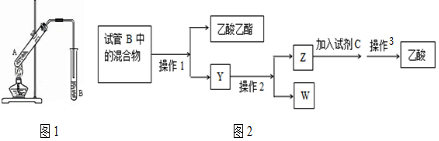
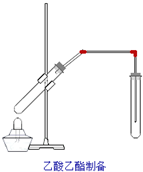 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |||
| 起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
| A. | x=y=0.16 | |
| B. | 反应开始时,乙中反应速率比甲快 | |
| C. | 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(L•min) | |
| D. | 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
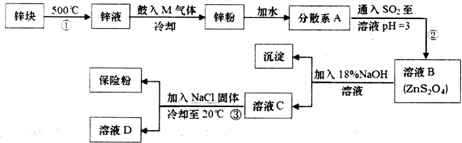
 .分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).
.分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com