
 苹果酸是一种常见的有机酸,其结构简式如图所示:
苹果酸是一种常见的有机酸,其结构简式如图所示:分析 由结构简式可知有机物含有羟基、羧基,可发生取代、氧化、消去、酯化反应,具有酸性,可发生中和反应,以此解答该题.
解答 解:(1)由结构简式可知有机物分子式为C4H6O5,故答案为:C4H6O5;
(2)有机物含有的官能团有羟基、羧基,故答案为:羟基、羧基;
(3)苹果酸中含有羧基、醇羟基,含有羧基,能和Na、NaOH、碳酸氢钠反应,能和醇发生酯化反应,具有醇羟基,能发生酯化反应、氧化反应、消去反应、取代反应,能燃烧,不含不饱和键,所以不能发生水解反应、加聚反应,故答案为:②③;
(4)有机物含有2个羧基、1个羟基,则1mol苹果酸与足量的钠反应最多产生1.5mol氢气,故答案为:1.5mol;
(5)苹果酸中的醇羟基能和乙酸发生酯化反应生成酯和水,反应方程式为:HOOC-CH(OH)-CH2-COOH-CH3COOH$?_{△}^{浓硫酸}$HOOC-CH(OOCCH3)-CH2-COOH+H2O,
故答案为:HOOC-CH(OH)-CH2-COOH-CH3COOH$?_{△}^{浓硫酸}$HOOC-CH(OOCCH3)-CH2-COOH+H2O.
点评 本题考查有机物的结构和性质,明确有机物中官能团及其性质关系是解本题关键,熟练掌握常见有机物的官能团,物质反应条件,条件不同产物不同,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6 L | B. | 11.2 L | C. | 22.4 L | D. | 33.6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置吸收二氧化硫气体 | |
| B. |  用装置除去氯气中的氯化氢杂质 | |
| C. |  用装置可以对硫化氢气体进行尾气处理 | |
| D. |  用装置制备并收集氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
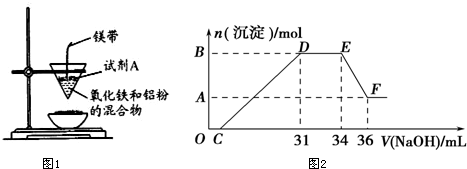
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.04mol/(L•s) | ||
| C. | v(C)=0.03mol/(L•s) | D. | v(D)=0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| B. | 提取溶解在水中的少量碘时加入CCl4,分液,取出有机层再分离 | |
| C. | 用适量苯和液溴混合制溴苯时,只需加铁屑,不必加热 | |
| D. | 除去溴苯中的少量Br2时加入KI溶液,充分反应后,弃去水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
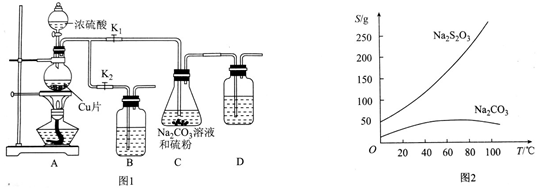
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴苯(溴) 加氢氧化钠再分液 | B. | 乙酸(乙醇)用蒸馏 | ||
| C. | 乙酸乙酯(乙酸)直接分液 | D. | 乙烷(乙烯)用酸性高锰酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com