
 ��
�� ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��-44.2 kJ��mol-1 | B��+44.2 kJ��mol-1 ��� ��ʼ״̬(mol) ƽ��ʱHBr(g) ���ʵ���(mol) |
| C��-330 kJ��mol-1 | D��+330 kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2 LҺ̬ˮ�ֽ��2L������1L��������571.6kJ���� |
| B��2 mol������1mol������Ӧ����2mol��̬ˮ�ų���������571.6kJ |
| C������ͬ�����£�2 mol������1mol�����������ܺʹ���2molҺ̬ˮ������ |
| D��ʹ�ô����ܽ��÷�Ӧ�Ļ��ʹ��Ӧ�ų�������С��571.6kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.22 mol | B��0.15 mol |
| C��0.1 mol | D��0.05 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaOH +HCI |
| B��NaOH�� aq��+HC1�� aq�� |
| C��NaOH��1��+HCl��1�� |
| D��NaOH�� aq��+HCl�� aq�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
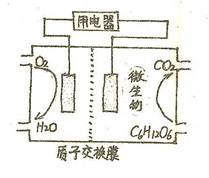
 һ�Ƕ��顣��101 kPaʱ��10 kg���飨��Է�������Ϊ58����ȫȼ������CO2��Һ̬H2O�ų�����5��105 kJ�������ȼ����Ϊ___________������ȼ�յ��Ȼ�ѧ����ʽΪ_________________________________________________��
һ�Ƕ��顣��101 kPaʱ��10 kg���飨��Է�������Ϊ58����ȫȼ������CO2��Һ̬H2O�ų�����5��105 kJ�������ȼ����Ϊ___________������ȼ�յ��Ȼ�ѧ����ʽΪ_________________________________________________�� FeO(s) ?
FeO(s) ? 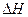 =��272.0KJ/mol
=��272.0KJ/mol Al2O3(s) ?
Al2O3(s) ? 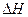 =��1675.7KJ/mol
=��1675.7KJ/mol �� Al(s)�ĵ��ʺ�FeO(s)��Ӧ���Ȼ�ѧ����ʽ��_____________________________________��
�� Al(s)�ĵ��ʺ�FeO(s)��Ӧ���Ȼ�ѧ����ʽ��_____________________________________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2Q1+ Q2 > 4Q3 | B��2Q1+Q2<4Q3 |
| C��Q1 +Q2 <Q3 | D��Q1+Q2=Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ϡ��Һ�����кͷ�Ӧ���к���Ϊ57.3 kJ/mol�������ȼ����Ϊ5518 kJ/mol�������Ȼ�ѧ����ʽ��д��ȷ���ǣ� ��
ϡ��Һ�����кͷ�Ӧ���к���Ϊ57.3 kJ/mol�������ȼ����Ϊ5518 kJ/mol�������Ȼ�ѧ����ʽ��д��ȷ���ǣ� ��| A��2H+(aq) +SO42��(aq)+Ba2+(aq)+2OH��(aq)=BaSO4(s)+2H2O(1)����H=��57.3 kJ/mol |
B��KOH(aq )+ )+ H2 SO4(aq)=K2SO4(aq)+H2O(l)����H=��57.3kJ/mol H2 SO4(aq)=K2SO4(aq)+H2O(l)����H=��57.3kJ/mol |
| C��2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1)����H=��5518 kJ/mol |
| D��C8H18(l)+ 25/2 O2(g)=8CO2(g)+ 9H2O(1)����H=��5518 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ȳ��ȼ����Ϊ1256kJ/mol |
| B����ת��10mol���ӣ�������2.5mol O2 |
| C��������2molҺ̬ˮ�����H����2512kJ/mol |
| D�����γ�4mol̼�����õ��Ӷԣ���ų�������Ϊ2512kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com