
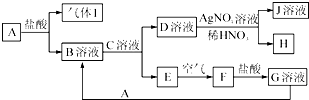
 已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示.
已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示. .
. 分析 已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀判断为Fe(OH)3,G为氢氧化铁和盐酸反应生成的氯化铁溶液,E为Fe(OH)2,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色说明含K元素,H为AgCl,D溶液为KCl溶液,推断C溶液为KOH溶液,B溶液为FeCl2,A为Fe,气体1为H2,
(1)J为KNO3,农业生产上做钾肥;
(2)分析判断C为KOH;
(3)A是铁和盐酸反应生成氯化亚铁和氢气;
(4)E→F的化学反应是氢氧化亚铁被空气氧化生成氢氧化铁的反应,氧气做氧化剂,结合元素化合价变化和电子守恒标注电子转移;
解答 解:已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀判断为Fe(OH)3,G为氢氧化铁和盐酸反应生成的氯化铁溶液,E为Fe(OH)2,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色说明含K元素,H为AgCl,D溶液为KCl溶液,推断C溶液为KOH溶液,B溶液为FeCl2,A为Fe,气体1为H2,
(1)J为KNO3,农业生产上做钾肥,物质J在农业生产上的一种重要用途是肥料,
故答案为:肥料;
(2)上述分析判断C溶液为KOH溶液,
故答案为:KOH;
(3)A是铁和盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(4)氢氧化亚铁被氧气氧化生成氢氧化铁,该反应中铁元素化合价由+4价变为+6价,氧元素化合价由0价变为-2价,得失电子数为4,所以其转移电子的方向和数目为:
故答案为:
点评 本题以铁为载体考查了物质间的转化,以红褐色沉淀焰色反应为突破口采用正逆相结合的方法进行推断,注意反应条件,难度难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 家用燃气灶是化学能转化为热能的应用装置 | |
| B. | 食品放入冰箱中,因为温度低,变质速率降低,所以食品能够保存较长时间 | |
| C. | 将煤气化,有利于提供更多的能量,而且有效地减少温室气体的产生 | |
| D. | 因为食用醋中含有酸,可以用来清洗锅垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12 L的H2O所含的原子数必大于1.5×6.02×1023 | |
| B. | 含有相同氧原子数的SO2和CO2的物质的量相等 | |
| C. | 常温常压下,48 g O3中含有的氧原子数为3NA | |
| D. | 标准状况下,2.24 L NH3和CH4的混合气体,所含电子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中子数为20的氯原子符号:20Cl | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HClO4的电离方程式:HClO4═H++ClO4- | |
| D. | Cl-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80mL 10mol/L的浓盐酸与足量的MnO2加热反应,产生Cl2分子数为0.2NA | |
| B. | 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA | |
| C. | 1L 1mol/L的Fe2(SO4)3溶液中含有的SO42-离子数为3NA | |
| D. | 常温常压下,等质量的CO和N2中含有的原子数目均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com