
解析:许多氢氧化物能和酸反应生成盐和水。把只与酸反应生成盐和水,而不能与碱反应生成盐和水的氢氧化物叫做碱;而把既能与酸反应生成盐和水,又能和碱反应生成盐和水的氢氧化物叫做两性氢氧化物。大量实验证明,Mg(OH)2是碱,而Al(OH)3是最常见的典型的两性氢氧化物,它和盐酸及氢氧化钠的反应方程式为
Al(OH)3+3HCl![]() AlCl3+3H2O Al(OH)3+NaOH
AlCl3+3H2O Al(OH)3+NaOH![]() NaAlO2+2H2O
NaAlO2+2H2O
NaAlO2叫做偏铝酸钠。其中,氢氧化物与碱反应生成了盐和水,说明氢氧化物已经显示出了一定的酸性。
对酸和碱的认识还有一种理论,称之为“酸碱电离理论”。首先,把电解质在水中电离时,能完全电离成离子,而在水中没有电解质分子存在的电解质,叫做强电解质,例如NaOH、HCl、NaCl等强碱、强酸和大部分盐等,电离时用等号表示,如NaOH![]() Na++OH-;而把在水中,只有部分电离成离子,还有电解质分子存在的电解质,叫做弱电解质,电离时用可逆号“
Na++OH-;而把在水中,只有部分电离成离子,还有电解质分子存在的电解质,叫做弱电解质,电离时用可逆号“![]() ”,例如 NH3·H2O
”,例如 NH3·H2O![]()
![]() +OH-,Mg(OH)2溶于水以后,也有极少部分未发生电离,而Al(OH)3在水中则同时存在着两种电离趋势,电离方程式可表示为
+OH-,Mg(OH)2溶于水以后,也有极少部分未发生电离,而Al(OH)3在水中则同时存在着两种电离趋势,电离方程式可表示为
H++![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-
Al3++3OH-
酸式电离 碱式电离
答案:由所给的试剂可以分析设计,先用两支试管,分别取MgCl2溶液、AlCl3溶液,再分别加入适量NaOH溶液,制得Mg(OH)2和Al(OH)3白色沉淀物,然后再将制得的氢氧化物分别分成两份,向一份中继续加入NaOH溶液,另一份加入盐酸。发现Mg(OH)2不溶于NaOH溶液只溶于盐酸;而Al(OH)3既能溶于NaOH溶液又能溶于盐酸,均变成无色透明的溶液。Mg(OH)2不溶于NaOH溶液只溶于盐酸,说明它只有碱的性质,没有酸的性质;而Al(OH)3溶于盐酸,说明它具有碱的性质,又能溶于NaOH溶液,说明已经显示出酸的性质,说明它的碱性比Mg(OH)2的碱性弱。进而说明金属镁比铝失电子的能力强。


科目:高中化学 来源: 题型:
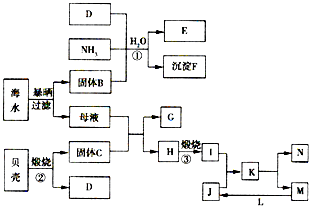 [化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
[化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
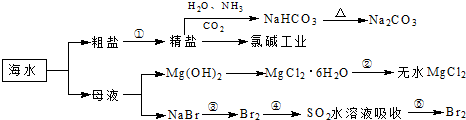
| A、过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 | C、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 | D、工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源:学习高手必修二化学鲁科版 鲁科版 题型:043
如何利用MgCl2溶液、AlCl3溶液、NaOH溶液和盐酸等设计实验,进行Mg(OH)2、Al(OH)3碱性强弱的对比性实验,来探究说明镁和铝两种元素原子失电子能力的强弱?
查看答案和解析>>
科目:高中化学 来源:高中化学新课标鲁科版 必修Ⅱ 鲁科版 题型:043
如何利用
MgCl2溶液、AlCl3溶液、NaOH溶液和盐酸等设计实验,进行Mg(OH)2、Al(OH)3碱性强弱的对比性实验,来探究说明镁和铝两种元素原子失电子能力强弱?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com