

 (填结构式);
(填结构式); .
. 分析 由球棍模型可知,A为CH4,B为CH2=CH2,C为C2H6.
(1)等质量烃完全燃烧时,H元素质量分数越大消耗O2的量越多,则甲烷消耗氧气最多;
(2)等质量烃完全燃烧,碳元素质量分数越大,生成二氧化碳越大,H元素质量分数越大,生成的水越多;
(3)相同状况下,等体积的三种物质,它们的物质的量相等,根据1mol烃CxHy消耗(x+$\frac{y}{4}$)mol氧气,可知消耗氧气最多的为乙烷.
解答 解:由球棍模型可知,A为CH4,B为CH2=CH2,C为C2H6.
(1)等质量烃完全燃烧时,H元素质量分数越大消耗O2的量越多,则CH4消耗氧气最多,与氧气反应方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,
故答案为:CH4;CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
(2)等质量烃完全燃烧,乙烯中碳元素质量分数越大,生成二氧化碳最多的是CH2=CH2,甲烷中H元素质量分数越大,生成的水越多甲烷,结构式为 ;
;
故答案为:CH2=CH2; ,
,
(3)相同状况下,等体积的三种物质,它们的物质的量相等,根据1mol烃CxHy消耗(x+$\frac{y}{4}$)mol氧气,可知消耗氧气最多的为乙烷,电子式为: ,
,
故答案为:乙烷; .
.
点评 本题考查有机物结构、烃燃烧规律,难度不大,注意根据燃烧通式理解掌握燃烧规律.


科目:高中化学 来源: 题型:选择题
| A. | 过量的NaHSO4与Ba(OH)2溶液的反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 酸性条件下KIO3和KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6 OH- | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气用于自来水消毒没有任何有毒物质残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
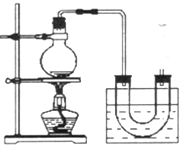 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
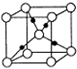 已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.
已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,28g CO中含有的分子数为NA | |
| B. | 1.0 mol•L-1 Na2SO4溶液中所含的Na+数为2NA | |
| C. | 标准状况下,22.4 L HCl气体中所含的原子数为NA | |
| D. | 1 mol N2所含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3 | B. | CH3CH2OH | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
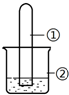 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | NH3 | AlCl3溶液 | 产生白色沉淀 |
| D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com