
| A. | 无 | B. | ①②⑤ | C. | ①②④⑤ | D. | ①②③ |
分析 ①只由一种物质构成的是纯净物;
②能和碱反应生成盐和水的氧化物为酸性氧化物;
③在水溶液中能完全电离的电解质为强电解质;
④由同种元素形成的不同种单质间互为同素异形体;
⑤常见的胶体有河水、大气、淀粉溶液、蛋白质溶液、雾和墨水等.
解答 解:①只由一种物质构成的是纯净物,故蓝矾、液态氯化氢、冰水混合物为纯净物,故正确;
②Mn2O7、P2O5、SO3、CO2均能和碱反应生成盐和水,故为酸性氧化物,故正确;
③明矾、烧碱、硫酸钡在水溶液中能完全电离,故为强电解质,故正确;
④C60、金刚石、石墨是由同种元素形成的不同种单质,故互为同素异形体,故正确;
⑤常见的胶体有河水、大气、淀粉溶液、蛋白质溶液、雾和墨水、血液等,故蛋白质溶液、淀粉溶液、雾、墨水均为胶体,故正确,
故选A.
点评 本题考查了常见的化学用语,难度不大,应注意的是酸性氧化物的辨别和强电解质的概念.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
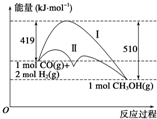 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91 kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量小于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH,则△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔检验豆浆的丁达尔现象 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 用萃取的方法分离汽油和煤油 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与水蒸气反应的产物是黑色的Fe2O3 | |
| B. | 红热的铁能与水蒸气反应,放出的气体点燃时能发出爆鸣声 | |
| C. | 铁与水蒸气的反应是氧化还原反应 | |
| D. | 常温下,Fe与H2O不反应,但在空气中的O2、H2O共同作用下能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一次 | 第二次 | 第三次 | |
| 体积(mL) | 16.10mL | 16.60mL | 15.90mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱(Na2CO3)从物质的分类看不属于碱 | |
| B. | 由一种元素组成的物质一定是单质 | |
| C. | 凡是能电离出H+的化合物均属于酸 | |
| D. | 盐类物质一定含有金属离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com