
分析 根据公式n=$\frac{N}{{N}_{A}}$和M=$\frac{m}{n}$得M=$\frac{m{N}_{A}}{N}$,据此公式计算即可计算气体的摩尔质量,结合V=nVm,求气体的体积.
解答 解:M=$\frac{m{N}_{A}}{N}$=$\frac{3.2g×6.02×1{0}^{23}/mol}{3.01×1{0}^{22}}$=64g/mol,V=nVm=$\frac{3.2}{64}×22.4$=1.12L,答:气体的摩尔质量是64g/mol,其所具有的体积是1.12L.
点评 本题考查了有关物质的量的计算,能灵活运用公式是解本题的关键,难度不大,注意摩尔质量的单位是g/mol.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 14 g分子式为CnH2n的烃中含有的C-H键的数目为2NA | |
| B. | 2.24 L(标准状况)甲烷与7.1 g氯气在光照条件下反应得到CH3Cl的分子数为0.1NA | |
| C. | 含有10.7 g Fe(OH)3的氢氧化铁胶体中,氢氧化铁胶粒总数为0.1NA | |
| D. | 100g 17%的氨水,溶液中含有的NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
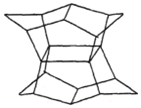 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )| A. | 分子式为C20H20 | B. | 一氯代物的同分异构体只有两种 | ||
| C. | 分子中含有4个亚甲基(-CH2-) | D. | 分子中含有12个五元碳环 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量就是物质的相对分子质量 | B. | 摩尔质量就1mol物质所具有的质量 | ||
| C. | HNO3的摩尔质量是63g | D. | 硫酸和磷酸的摩尔质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
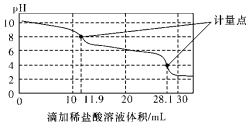 实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )| A. | 上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| B. | 下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- | |
| C. | 此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol | |
| D. | 使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -332 | B. | +260 | C. | +350 | D. | +130 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 晶体硅 | S |
| C | CH3COONa | 水晶 |  |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是:
铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是: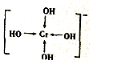 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com