
【题目】下列叙述不正确的是
A. 0.1mol/L氨水中,c(OH-)=c(NH4+)
B. 在常温下,10mL 0.02mol/L HCl溶液与10mL 0.02mol.LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
C. 新制氯水中c(Cl-)=c(ClO-)+c(HClO)
D. 0.1mol/L KHC2O4溶液显酸性,溶液中c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4)
【答案】A
【解析】A、0.1mol/L氨水中,c(OH-)来源于水电离和NH3·H2O 的电离,写成c(OH-)=c(NH4+),没有考虑水电离,故A错误;B、在常温下,10mL 0.02mol/L HCl溶液与10mL 0.02mol.LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,反应后的溶液中c(OH-)=![]() =0.01mol·L-1,c(H+)=
=0.01mol·L-1,c(H+)=![]() mol·L-1=1×10-12mol·L-1,PH=-lg1×10-12=12,故B正确;C、新制氯水还有没有反应的Cl2分子,故C错误;D、0.1mol/L KHC2O4溶液显酸性,KHC2O4溶液显酸性说明HC2O4-的电离程度大于水解程度,因此c(C2O42-)大于c(H2C2O4),溶液中c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4),故D正确;故选A。
mol·L-1=1×10-12mol·L-1,PH=-lg1×10-12=12,故B正确;C、新制氯水还有没有反应的Cl2分子,故C错误;D、0.1mol/L KHC2O4溶液显酸性,KHC2O4溶液显酸性说明HC2O4-的电离程度大于水解程度,因此c(C2O42-)大于c(H2C2O4),溶液中c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4),故D正确;故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
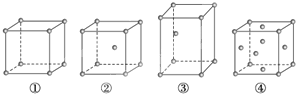
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是( ) 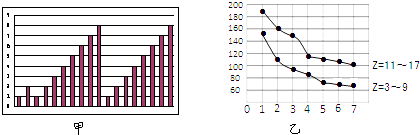
A.图甲横坐标为原子序数,纵坐标表示元素的最高正价
B.图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C.图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D.图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应: N2(g) +3H2(g)![]() 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=________。
(2)平衡后,若要提高H2的转化率,可以采取的措施有________。
A.加了催化剂 B.增大容器体积 C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1________K2(填“<”、“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.v(H2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为________。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”、“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为________。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”、“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组采用分类思想、利用抽象方程式:A+H2O→B+C总结相关物质的知识。
(1)若A为单质:
①金属氧化物B常作为磁性材料,则元素A在周期表中的位置为_________。
②A是一种黄绿色气体单质,则生成物中弱电解质的结构式为_________。
③B能腐蚀玻璃,单质C为空气的主要成分之一,写出该反应的化学方程式: _________。
(2)若A为氧化物:
①A为淡黄色固体,则A的电子式为_________。
②A、C均能造成光化学烟雾,则生成1molB转移的电子数目为_________。
(3)若B俗称酒精,C是生活中食用醋的主要成分,则有机物A的名称是_________。另外,A为盐时还可能发生盐类的水解,用以总结水解的规律及微粒浓度的关系等知识。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题: 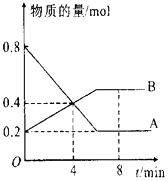
(1)请问哪条曲线代表反应物;
(2)该反应为可逆反应,请说明依据;
(3)反应开始至4min时,A的平均反应速率为 , 此时V正V逆(填“>”“<”或“=”);
(4)8min时,反应是否达平衡状态?(填“是”或“否”);
(5)反应进行至4min时,反应物的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
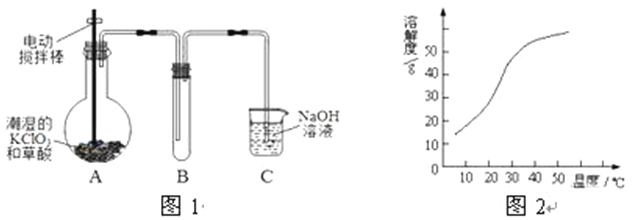
(1) A 装胃电动搅抖柞的作用是___________
(2)B装置必须放在冰水浴中,其原因是___________
(3)反应后在装置C中可得NaClO2溶液。已知I.NaClO2饱和溶液在温度低了38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2, 温度高于60℃时NaClO2分解生成NaClO3和NaCl;
Ⅱ.NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②__________;③用38℃~60℃热水洗涤;④_____;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL(已知2 Na2S2O3+ I2=Na2S4O6+ 2NaI)。
①配制100 mLcmol·L-1Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:____________。
②原ClO2溶液的浓度为_________g/L(用含字母代数式表示)。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____________。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com