
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
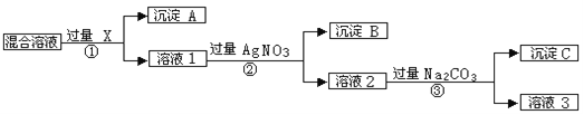
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______。
(2)证明AgNO3溶液加过量的实验方是_____________________________________________ 。(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:_________________________________ (填编号字母)。
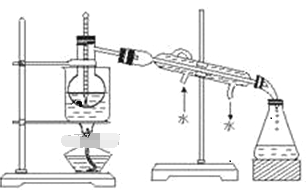
(2)从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有______ 处。
(3)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
【答案】 BaCl2或Ba(NO3)2 取滤液或溶液2少许于试管,加入稀盐酸,若产生白色沉淀,证明AgNO3过量 Na2CO3 HNO3 蒸发 CBDAHGEF 4 蒸馏烧瓶
【解析】Ⅰ.除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液,由实验流程可知,如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的X为BaCl2[或Ba(NO3)2],生成沉淀A为BaSO4沉淀,然后在溶液1中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,即沉淀B为AgCl,再向所得溶液2中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,沉淀C为碳酸钡、碳酸银,最后所得溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3。
(1)由上述分析可知,X为BaCl2或Ba(NO3)2,故答案为:BaCl2或Ba(NO3)2;
(2)证明AgNO3加过量的实验方法是取滤液或溶液2少许于试管,加入稀盐酸,若产生白色沉淀,证明AgNO3过量,故答案为:取滤液或溶液2少许于试管,加入稀盐酸,若产生白色沉淀,证明AgNO3过量;
(3)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,之后蒸发、过滤得到硝酸钠,故答案为:Na2CO3;HNO3;蒸发;
Ⅱ.(1)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,则正确的顺序为:C→B→D→A→H→G→E→F,故答案为:CBDAHGEF;
(2)从含碘的CCl4溶液中提取碘和回收CCl4,还需要经过蒸馏,蒸馏时温度计水银球应放在蒸馏烧瓶支管口处;冷凝水应从下口进入上口流出;尾接管与锥形瓶之间有塞子;烧杯加热应垫上石棉网;所以共4处错误;故答案为:4;
(3)碘的沸点为184℃,比四氯化碳沸点高,所以最后晶态碘在蒸馏烧瓶里聚集;故答案为:蒸馏烧瓶。


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】请结合下图回答问题: 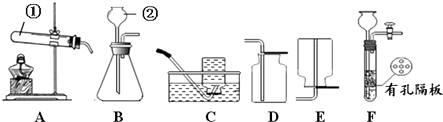
(1)写出有标号的仪器名称:① , ② .
(2)实验室用高锰酸钾制取O2的化学方程式为 , 用A、C装置制取O2时,为防止高锰酸钾进入导管,可采取的措施是 .
(3)实验室用B、D装置制取CO2的化学方程式为 , 若将发生装置由B改为F,其优点是 .
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水.SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气.用下图所示装置收集一瓶干燥的SO2 , 装置中导管按气流方向连接顺序是→⑤(填序号);图中漏斗的作用是;烧杯中NaOH溶液的作用是(用化学方程式表示). 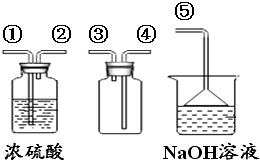
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,请根据以上信息和相关知识判断,下列分析不正确的是( )

A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”敞口放置一段时间后浓度会变小
C. 取100 mL该“84消毒液”稀释100倍用以消毒,稀释后溶液中c(Na+)约为0.04mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
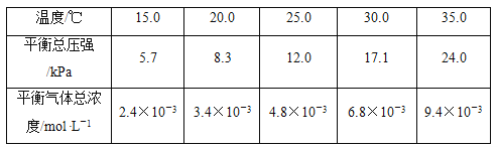
(1)可以判断该分解反应已经达到平衡的是________(填字母序号)。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解平衡常数:____________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”“减少”或“不变”)。
(4)氨基甲酸铵分解反应的焓变ΔH____0(填“>”“=”或“<”,下同),熵变ΔS____0。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com