



科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)大气中氟氯烃的减少带来的积极效应是_________________________________________。
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质。
①若用NOx表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
![]()
②酸雨落至地面后pH在一定时间内变小然后稳定于某数值,原因是H2SO3受空气影响造成的,其化学方程式为_________________________________________。
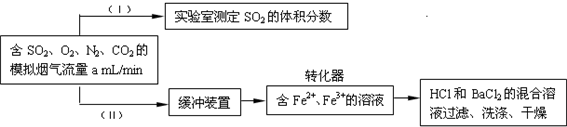
(3)回收利用SO2既能减少大气污染,又能充分利用资源。已知:Fe2+、Fe3+作催化剂,标准状况下在转换器中SO2可被O2氧化成![]() ,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下:
,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下:

①在实验(Ⅰ)中,为了确定SO2的体积分数,可将模拟烟气缓慢通过已知体积和浓度的__________溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标准状况下)来计算SO2的体积分数。
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气体流速,还需测定的数据是__________和__________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
“关注民生”和“科学发展”是“十七大”报告的主题之一,环境问题与“民生”和“科学发展”密切相关。世界环保组织2006年度报告指出,在所有衡量地球健康状况的指标中,人类仅成功地扭转了一项指标的恶化-大气中氯氟烃减少,而C、S、N氧化物的排放有增无减,水资源的紧缺和污染加剧。保证经济走可持续发展的道路,是化学工作者应尽的职责所在。回答下列问题:
(1)大气中氯氟烃的减少带来的积极效果是 ;
(2) 酸雨的化学特征是 。空气中硫氧化物和氮氧化物是形成酸雨的主要物质。若用NOx表示氮氧化物,请写出空气中氮氧化物形成酸雨的化学方程式
;
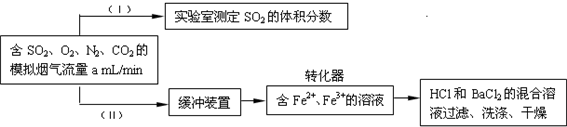
(3) SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:

① 在实验室测定模拟烟气中SO2的体积分数,现有注射器、洗气瓶、导管、量筒等仪器,需要的药品有 ;
② 若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,已知气体流速,还需测定的数据是 ;
(4)水体富营养化是导致水体藻类大量繁殖的主要因素。2007年春夏之交我省无锡太湖蓝藻事件再次给水资源保护敲响警钟。检测显示,蓝藻爆发时太湖全湖N、P平均含量分别高达4.0和0.13 mg/L。环境专家建议用金属镁将水体中的NO3-还原为N2而消除污染,Mg则转变为Mg(OH)2沉降湖底。要使太湖水中N的平均含量下降至0.20 mg/L,则每立方米水体中应投入的镁粉应不少于 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com