
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |

分析 (1)升高温度平衡向吸热反应方向移动,根据温度与化学平衡常数关系确定反应热;根据化学平衡计算计算CO的转化率;
(2)各物质起始物质的量均为1:1等于化学计量数之比,结合方程式可知,故平衡时n(CO)=n(H2O)、n(CO2)=n(H2),由于500℃时平衡常数K=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=9可知,平衡时n(CO2)≠n(CO),则转化率不是50%;
B中转化到左边可以得到2molCO、2molH2O,恒温恒容下B、C是完全等效平衡,平衡时相同物质的浓度相同、物质的量相同;
恒温恒容下,C等效为在A的基础上增大压强,反应前后气体体积不变,平衡不移动,反应物转化率相等、相同物质的含量相等;
(3)不传热的固定容积的容器中,反应达到平衡的标志是正逆反应速率相同,各成分含量保持不变分析判断选项;
(4)在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,可以通过改变温度、改变水蒸气或氢气的量实现;t4时刻通过改变容积的方法将压强增大为原先的两倍则体积变为原来的一半,故浓度分别增大为原来的2倍,又反应前后气体系数相等,平衡不移动.
解答 解:(1)随着温度的升高,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应;
设CO的转化率为x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始 1mol 2mol 0 0
反应 x x x x
平衡(1-x)mol (2-x)mol xmol xmol
化学平衡常数K=$\frac{x×x}{(1-x)×(2-x)}$=1,x=66.7%;
故答案:放;66.7%;
(2)各物质起始物质的量均为1:1等于化学计量数之比,结合方程式可知,故平衡时n(CO)=n(H2O)、n(CO2)=n(H2),由于500℃时平衡常数K═$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=9可知,平衡时n(CO2)≠n(CO),则转化率不是50%;
B中转化到左边可以得到2molCO、2molH2O,恒温恒容下B、C是完全等效平衡,平衡时相同物质的浓度相同、物质的量相同,则:c2=c3,B、C平衡时n(CO2)≠n(CO),转化率不是50%,故Q2≠Q3,设平衡时CO为ymol,则α3=$\frac{y}{2}$,α2=$\frac{2-y}{2}$,故α3+α2=1,可推知α3≠α2;
恒温恒容下,C等效为在A的基础上增大压强,反应前后气体体积不变,平衡不移动,反应物转化率相等、相同物质的含量相等,则:α1=α3,c3=2c1,Q3=2Q1,
结合上述分析可知:2c1=c2=c3 ,Q3=2Q1≠Q2=Q3 ,α1=α3≠α2 ,α1+α2=1,
故选:AD;
(3)在一个绝热等容的容器中,判断此流程的第Ⅱ步反应CO(g)+H2O(g)?H2(g)+CO2(g),达到平衡的标志是正逆反应速率相同;各组分含量保持不变;
①虽然反应前后气体体积不变,但由于绝热等容容器中反应过程中有温度变化,所以压强也在变化,体系的压强不再发生变化能判断反应达到平衡,故①符合;
②反应中混合气体质量守恒,体积不变,密度不变,混合气体的密度不变不能说明反应达到平衡,故②不符合;
③反应前后气体质量守恒,反应前后气体体积不变,物质的量不变,混合气体的平均相对分子质量不变,不能说明反应达到平衡,故③不符合;
④各组分的物质的量浓度不再改变是平衡的标志,故④符合;
⑤体系的温度不再发生变化绝热容器温度不变,说明反应达到平衡,故⑤符合;
⑥反应速率之比等于化学方程式计量数之比,v(CO2)正=v(H2O)逆,说明水蒸气的正逆反应速率相同,故⑥符合;
故答案为:②③;
(4)在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,且CO和CO2浓度变化有接触点,所以可以通过改变降低温度、增大水蒸气的量或减少氢气的量实现;t4时刻通过改变容积的方法将压强增大为原先的两倍,则体积变为原来的一半,故浓度分别增大为原来的2倍,又反应前后气体系数相等,平衡不移动,所以图象仅仅是浓度分别变为原来的2倍并且保持不变,如图为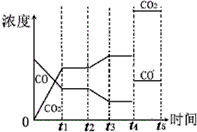 ,故答案为:降低温度;增加水蒸气的量;
,故答案为:降低温度;增加水蒸气的量; .
.
点评 本题考查了化学平衡移动原理,明确化学平衡常数的含义结合化学平衡常数公式进行有关计算,灵活运用三段式法进行解答,会分析图象中曲线变化特点,题目难度很大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ③④⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| B. | 实验室可用排饱和食盐水的方法收集氯气 | |
| C. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| D. | 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1<Q2 | |
| B. | △H1能表示单质碳的标准燃烧热 | |
| C. | 生成物总能量均低于反应物总能量 | |
| D. | 1molCO2气体具有的能量大于1mol干冰具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com