
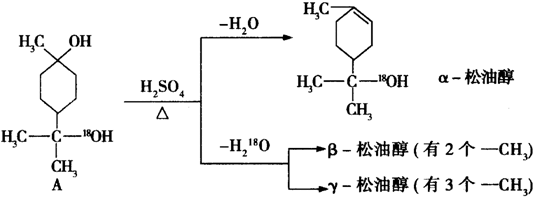
 $→_{△}^{浓硫酸}$
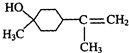
$→_{△}^{浓硫酸}$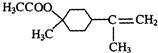 +H2O.
+H2O.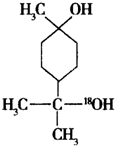 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$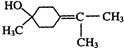 +H218O,该反应的反应类型是消去反应.
+H218O,该反应的反应类型是消去反应. 分析 (1)由α-松油醇的结构简式可看出分子中含有醇羟基,羟基连接碳原子上没有氢原子,不能被酸性高锰酸钾溶液氧化,不含不饱和键;
(2)A发生消去反应生成β-松油醇分子为 ;
;
(3)A发生消去反应生成γ-松油醇为 .
.
解答 解:(1)a.羟基连接碳原子上没有氢原子,不能被酸性高锰酸钾溶液氧化,不能使酸性KMnO4溶液褪色,故a错误;
b.含有醇羟基,能与氢卤酸发生取代反应转化为卤代烃,故b正确;
c.没有不饱和键,不能发生加成反应,故c错误;
d.含有醇羟基,可以发生取代反应,故d正确,
故选:ac;
(2)A发生消去反应生成β-松油醇分子为 ,分子中含有7种化学环境不同的H原子,与乙酸反应转化为酯的反应方程式是:CH3COOH+
,分子中含有7种化学环境不同的H原子,与乙酸反应转化为酯的反应方程式是:CH3COOH+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为:7;CH3COOH+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(3)A发生消去反应生成γ-松油醇为 ,反应方程式为:
,反应方程式为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H218O,
+H218O,
故答案为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H218O,消去反应.
+H218O,消去反应.
点评 本题考查有机物的结构与性质,把握官能团与性质的关系为解答的关键,侧重醇、烯烃性质的考查,注意醇发生氧化反应的结构特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg的金属性比Al强 | B. | H-的离子半径大于Li+ | ||
| C. | HCl的热稳定性比HF强 | D. | HClO4的酸性比H3PO4强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V=336 mL时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| B. | V=448 mL时,2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | |
| C. | V=672 mL时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) | |
| D. | 通入CO2过程中恒有关系式:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:1:1 | C. | 1:2:3 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
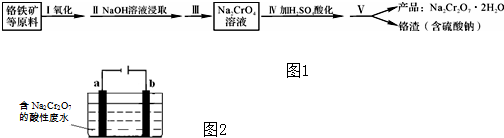
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
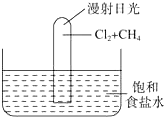 如图所示实验,试推测可能观察到的现象是:
如图所示实验,试推测可能观察到的现象是:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com