
| A. | ①②⑤ | B. | ①④⑥ | C. | ②③⑥ | D. | ②⑤⑥ |
分析 ①氯气和水的反应为歧化反应;
②求出12.0g熔融的NaHSO4的物质的量,然后根据硫酸氢钠在熔融状态下只能电离为钠离子和硫酸氢根来分析;
③在标准状况下,HF为液体;
④求出17g羟基的物质的量,然后根据-OH中含9个电子来分析;
⑤Na2O和Na2O2均由2个钠离子和1个阴离子构成;
⑥铁离子在溶液中会水解.
解答 解:①氯气和水的反应为歧化反应,不能进行彻底,故转移的电子数小于NA个,故错误;
②12.0g熔融的NaHSO4的物质的量为0.1mol,而硫酸氢钠在熔融状态下只能电离为钠离子和硫酸氢根,故0.1mol硫酸氢钠在熔融状态下电离出的阳离子为0.1NA个,故正确;
③在标准状况下,HF为液体,故不能根据气体摩尔体积来计算其物质的量,故错误;
④17g羟基的物质的量为1mol,而-OH中含9个电子,故1mol-OH中含9NA个电子,故错误;
⑤Na2O和Na2O2均由2个钠离子和1个阴离子构成,故1molNa2O和Na2O2的混合物中含有的离子个数为3NA个,故正确;
⑥铁离子在溶液中会水解,故溶液中的Fe3+和SO42-离子数小于NA个,故正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:推断题
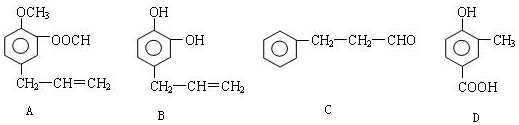
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
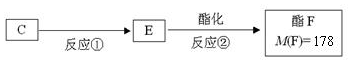
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2参加反应转移电子数一定为4NA | |
| B. | 一定条件下,足量铜与2 mol的浓硫酸充分反应,转移电子数为2NA | |
| C. | 300mL2mol/L乙醇溶液中所含乙醇分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 酒精、硫酸钡和水分别属于电解质、强电解质和弱电解质 | |
| C. | 胶体区别于其它分散系的本质特性是具有丁达尔现象 | |
| D. | 利用半透膜可除去淀粉溶液中的少量NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(NO3 )2(溶液) | B. | K2CO3(溶液) | C. | CH3COOK(固体) | D. | CuSO4 (固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
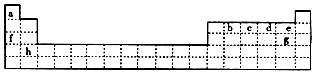
| A. | 若X、Y位于 IA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第3周期,则X、Y形成的化合物可能是离子化合物或共价化合物 | |
| C. | 若气态氢化物的沸点:X>Y,则X、Y只能位于周期表 VIIA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中的HCl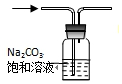 | |
| B. | 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 验证碳酸的酸性强于硅酸 | |
| D. | 分离苯和酒精 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com