
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“一”相连的两种物质能发生反应)。下列判断一定正确的是( )

A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期ⅠA族
C. 4种原子中,Y原子半径最大 D. W的最高化合价为+7
【答案】C
【解析】Y、Z为金属元素,由转化关系可知对应的最高价氧化物对应的水化物可发生反应,由原子序数关系可知Y为Na、Z为Al,则乙为NaOH,丙为Al(OH)3,甲、丁应为含氧酸,由原子序数关系可知X为N元素,甲为HNO3,W可能为S、Cl等元素,丁可为硫酸、高氯酸,由以上分析可知X为N、Y为Na、Z为Al、W可能为S、Cl等元素,则A.X为N元素,如为非金属性最强的元素,应为F,则无正价,A错误;B.Z为Al、位于周期表第三周期ⅢA族,B错误;C.Y为Na,为短周期半径最大的元素,C正确;D.如W为S,则最高化合价为+6价,D错误,答案选C。
电解:本题考查无机物的推断,侧重考查学生的分析能力,注意把握物质的性质以及转化关系,本题突破口为乙、丙的反应,另外需要注意F元素没有正价,氧元素没有最高价。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于能量转化的说法中,不正确的是
A. 电解水生成氢气和氧气时,电能转化为化学能
B. 绿色植物进行光合作用时,太阳能转化为化学能
C. 白炽灯工作时,电能全部转化为光能
D. 煤燃烧时,化学能主要转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列说法正确的是
A. 从海水中提取物质都必须通过化学反应才能实现
B. 糖类是食物组成中产生能世最高的营养物质
C. “低碳”生活倡导节能减排,禁止使用化石燃料
D. 我国成功实现了从可燃冰试开采中产出连续稳定的天然气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A为主要原料,采用以下路线合成药物X、Y和高聚物Z。

已知:I. (R或R可以是烃基或H原子)。
(R或R可以是烃基或H原子)。
II.反应①、反应②、反应⑤的原子利用率均为100%。
请回答下列问题:
(1)B的名称为______,X中的含氧官能团名称为________,反应③的条件为_____,反应④ 的反应类型是__________。
(2)关于药物Y ( )的说法正确的是(____)
)的说法正确的是(____)
A.药物Y的分子式为C8H8O4,遇氯化铁溶液可以发生显色反应
B. lmol药物Y与H2、浓溴水中的Br2反应,最多消耗H2、Br2分别为4 mol和2 mol
C. lmol 药物Y与足量的钠反应可以生成22.4L氢气
D.药物Y中⑥、⑦、⑧三处-OH的电离程度由大到小的顺序是⑧>⑥>⑦
(3)写出反应E→F的化学方程式__________。
(4)写出符合下列条件的E的所有同分异构体的结构简式_________。
① 属于酚类化合物,且是苯的对位二元取代物;② 能发生银镜反应和水解反应。
(5)设计一条以CH3CHO及CH3OH 为起始原料合成Z的线路(无机试剂及溶剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个甲醚燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)写出负极的电极反应式_____________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____(填“增大”、“ 减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为______。假设乙装置中氯化钠溶液足够多,若在标准状况下,有224mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将____________(填“增大”、“减小”或“不变”),且变化了_______克。
(5)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学探究学习小组的同学用下图所示装置制取氯气并探究氯气的某些性质。
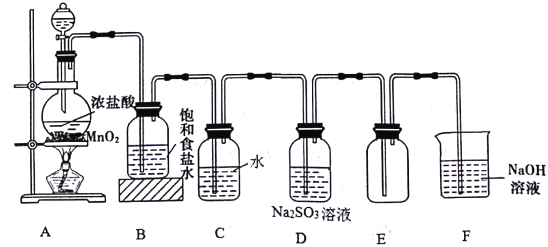
(1)装置A中制取Cl2的化学方程式为________________________。
(2)装置C中发生反应的离子方程式为_________________,反应后溶液中含Cl元素的分子有_________。
(3)实验结束后,测得装置D溶液中存在大量SO42-。Cl2通过装置D溶液时发生反应的离子方程式为 _____________ 。
(4)装置F的作用是______,该装置中发生反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
(1)H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为______ 元酸,其电离方程式是__________.
(2)H3PO2是中强酸,写出其与NaHCO3溶液反应的离子方程式______________________.
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则其氧化产物为_____________;(填化学式)
(4)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
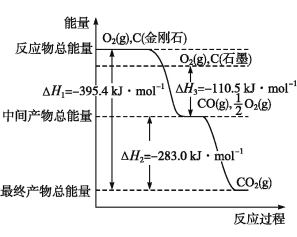
①在通常状况下,金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为 。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol1、497 kJ·mol1。
N2(g)+O2(g)![]() 2NO(g) ΔH=180.0 kJ·mol1。
2NO(g) ΔH=180.0 kJ·mol1。
NO分子中化学键的键能为 kJ·mol1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com