
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是________________。
(3)把KI换成KBr,则CCl4层变成________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为25.4mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况)。
(1)I2+5Cl2+6H2O=2HIO3+10HCl (写出反应物和生成物但未配平得1分,全对得3分)
(2)I2 (2分)
(3)橙红 (1分) HBrO3>Cl2 >HIO3(2分)
(4)13.44L(2分)
解析试题分析:(1)根据氧化还原反应方程式的配平原则,分析反应中的化合价变化,I元素的化合价从0→+5,升高5价,Cl元素的化合价从0→-1,降低1价,综合得失电子守恒和质量守恒,可配平出:I2+5Cl2+6H2O═2HIO3+10HCl;(2)分析整个过程中化合价升高的都是I元素,还原剂为:KI和I2;(3)KI换成KBr时,得到的是溴单质,则其在CCl4中呈红棕色;继续滴加氯水时,颜色不变,可知氯水不能将溴单质氧化成HBrO3,故其氧化性强弱顺序为:HBrO3>Cl2>HIO3;(4)1000kg加碘食盐中至少含碘25.4g,KI+3Cl2+3H2O=KIO3+6HCl,根据KIO3~I~KI~3Cl2可知,则需要消耗标准状况下Cl2的体积为: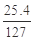 ×3×22.4L/mol=13.44L.
×3×22.4L/mol=13.44L.
考点:氧化还原反应;化学方程式的有关计算;氧化性、还原性强弱的比较;氧化还原反应方程式的配平;重要的还原剂;分液和萃取.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。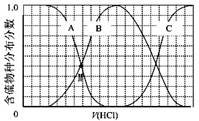
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为 。
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: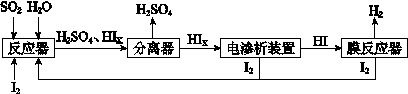
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学方程式是 。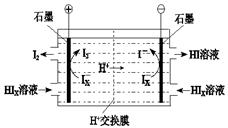
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-??H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)??Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理: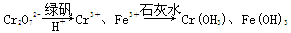
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
_______________________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示: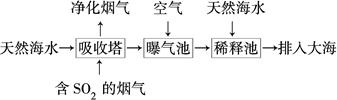
①向曝气池中通入空气的目的是_____________________________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。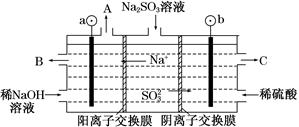
①图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
②SO32—放电的电极反应式为____________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释原因:
__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应氧化产物的物质的量分别是________________。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82—+2I-=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程:______________________________、____________________________(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案: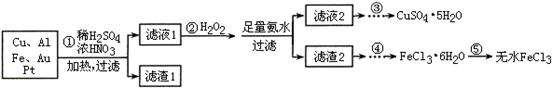
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
________KBrO3+________+________H2SO4―→……;
③若转移10 mol电子,则反应后生成I2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
 SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| III | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
肼(N2H4)是火箭发射常用的燃料。
(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。请写出该制法的化学反应方程式____________________________,当反应中转移0.2 mol电子 时,可制得Cu2O的质量为__________。
(2)一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。负极上发生的电极反应为_________________; ②电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。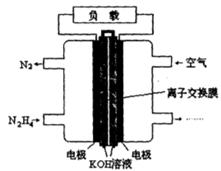
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com